A capacidade de a TC cardíaca fornecer um mapa anatómico preciso e excluir a presença de trombo intracardíaco é conhecida. O objetivo deste estudo foi avaliar o impacto da otimização de protocolos e evolução tecnológica nas doses de radiação e contraste e na qualidade de imagem dos exames de TC cardíaca prévia a ablação de fibrilhação auricular (FA).
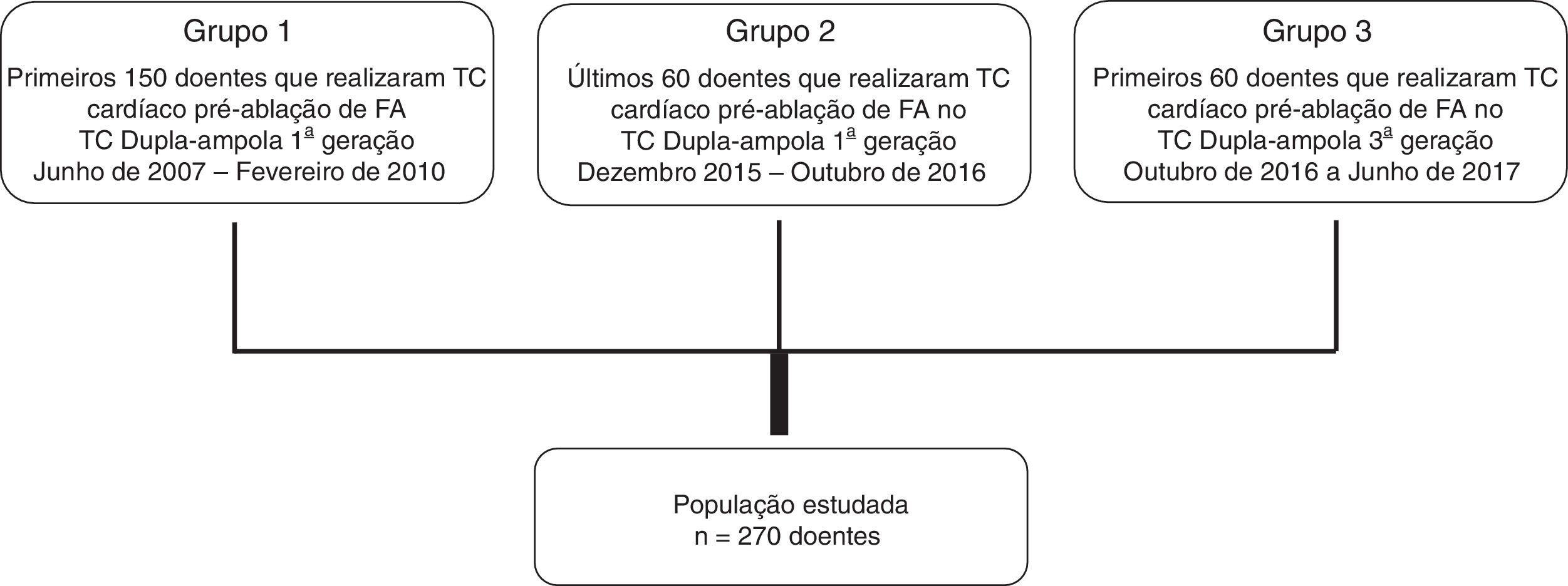
MétodosRegisto prospetivo de doentes consecutivos de centro único, foram incluídos os que fizeram TC cardíaca num contexto de avaliação prévia a ablação de FA (n=270), distribuídos em três grupos: Grupo 1, constituído pelos primeiros 150 doentes; Grupo 2, os últimos 60 doentes feitos no mesmo aparelho; Grupo 3, os primeiros 60 doentes do novo aparelho. Avaliámos a otimização do protocolo com base na dose de radiação, no volume de contraste, na necessidade de aquisição complementar e na avaliação objectiva da qualidade de imagem (rácios sinal/ruído, contraste/ruído e homogeneização de densidade AE/AAE).
ResultadosHouve uma redução significativa da radiação entre cada um dos grupos e da dose de contraste entre o primeiro e o último grupo (G1: 5,6mSv e 100ml; G2: 1,3mSv e 90ml; G3: 0,6mSv e 65ml). Apesar das menores doses de radiação e contraste, o Grupo 3 apresentou resultados significativamente melhores de qualidade de imagem (rácios sinal/ruído 13,5; contraste/ruído 14,8; homogeneização de densidade 0,92).
ConclusãoA otimização de protocolos e a evolução tecnológica permitiram reduções significativas nas doses de radiação e de contraste usadas na TC cardíaca pré‐ablação de FA, sem prejudicar a qualidade de imagem.
Cardiac computed tomography (CT) can provide a precise tridimentional anatomic map and exclude intra‐cardiac thrombus. We aimed to access the impact of CT protocol optimization and technological evolution on the contrast and radiation dose as well as on image quality previous to atrial fibrillation (AF) ablation.
MethodsFrom a prospective registry of consecutive patients who underwent cardiac CT in a single center, we selected 270 patients in whom the CT was done for evaluation prior to AF ablation and they were distributed in 3 groups: Group1: the first 150 patients included; Group2: the last 60 patients performed with the same CT scanner; Group3: the first 60 exams performed with the new CT scanner. Quality of the protocol was access based on radiation dose, contrast volume used, the use of a second (delayed) acquisition, and on quantitative image quality analisis (signal to noise and contrast to noise ratios; density homogeneity racio between LA and LAA).
ResultsWe found a significant radiation dose as well as contrast dose reduction between the first and last subgroups (G1: 5,6mSv and 100ml; G2: 1,3mSv and 90ml; G3: 0,6mSv and 65ml). Even though group 3 had less radiation and contrast used it still had better quantitative image quality (signal/noise of 13,5; contrast/noise 14,8; density homogeneity racio of 0,92).
ConclusionProtocol optimization and technology both contributed to significant lower radiation dose and contrast volume used on cardiac CTs prior to AF ablation, without compromising image quality.
O isolamento percutâneo das veias pulmonares está bem estabelecido para o tratamento da fibrilhação auricular, é uma área de grande desenvolvimento clínico e tecnológico nos últimos anos1. Antes da sua feitura, é necessária a exclusão de trombo intracardíaco, nomeadamente no apêndice auricular esquerdo (AAEsq)2–4. A obtenção prévia de mapa anatómico 3D da aurícula esquerda (AEsq) e das veias pulmonares facilita o procedimento, contribui para a sua segurança, reduz a radiação a que o doente é submetido durante a ablação e poderá aumentar a sua acuidade5–8.
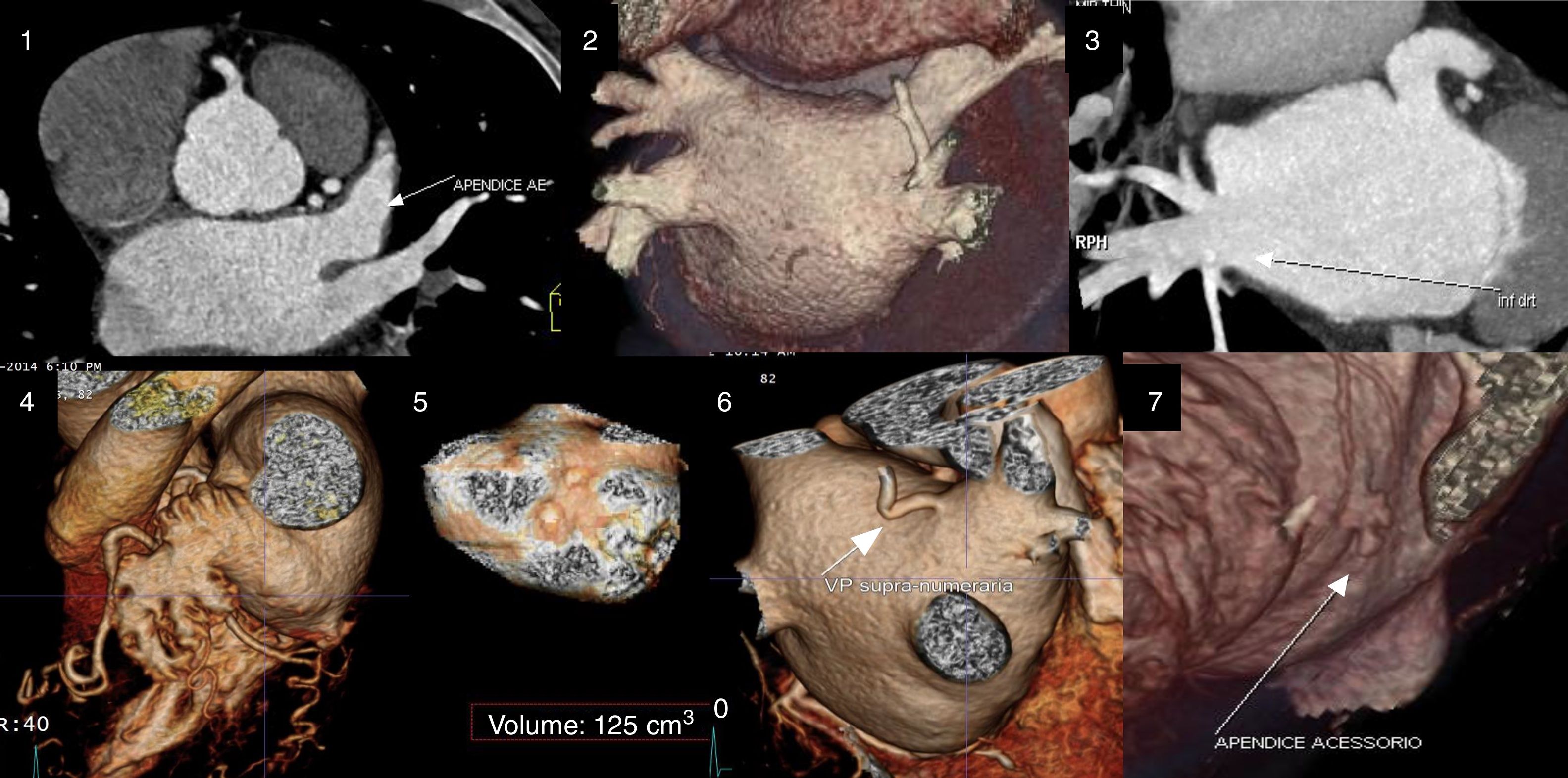
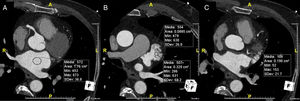
A tomografia computorizada (TC) cardíaca é um método imagiológico com capacidade para fornecer toda essa informação (exclusão de trombo e informação anatómica) de forma não invasiva9, pelo que tem ganhado preponderância nesses doentes (Figura 1)10. Este trabalho tem por objetivo avaliar a otimização dos protocolos de TC cardíaca prévia a ablação de fibrilhação auricular (pré‐ablação), tem por base a dose de radiação e de contraste e a qualidade diagnóstica, tem em conta o aumento da experiência do centro e os avanços tecnológicos disponíveis.
Avaliação por angioTC cardíaca da AEsq e do AAEsq.
Avaliação da permeabilidade do AAesq.
Avaliação da morfologia da AEsq e do padrão de drenagem das veias pulmonares.
Maior detalhe da drenagem da veia pulmonar inferior direita.
Detalhe morfológico do AAESq.
Avaliação volumétrica da AEsq.
Presença de veia pulmonar supranumerária com drenagem direta na AEsq.
Presença de pequeno apêndice acessório.
De um registo prospetivo de centro único de grande volume doentes submetidos a avaliação por TC cardíaca já descrito anteriormente11, selecionaram‐se todos aqueles cuja indicação foi a avaliação prévia a ablação de fibrilhação auricular (pré‐ablação). Desses foram constituídos três grupos de doentes consecutivos, independentes: Grupo 1 – Os primeiros 150 doentes consecutivos incluídos no registo; Grupo 2 – Os últimos 60 doentes efetuados com o mesmo aparelho de TC que tivemos disponível – TC dupla‐ampola de 1.ª geração, com 64 cortes (SOMATOM Definition®, Siemens Healthcare); Grupo 3 – Constituído com os primeiros 60 doentes efetuados com o novo aparelho de TC dupla‐ampola 3.ª geração – 192 detetores (SOMATOM Force®, Siemens Healthcare). (Figura 2). O Grupo 1 serviu de grupo controlo quando comparado com o Grupo 2, para avaliação da experiência na otimização dos exames. O Grupo 2 serviu de Grupo controlo quando comparado com o Grupo 3 para avaliação da evolução tecnológica na otimização dos exames.
Protocolo de aquisiçãoTodos os exames foram feitos dentro das 24h prévias à feitura do procedimento ablativo.
Protocolo de aquisição para o Grupo 1Exames feitos em TC dupla‐ampola 1.ª geração – 64 detetores – SOMATOM Definition®, com resolução temporal nativa de 83ms e velocidade de mesa (pitch) máximo de 45,7mm/s. Aquisição com protocolo retrospetivo, com modulação da miliamperagem – com 20% da miliamperagem fora dos intervalos de dose máxima, escolhidos da seguinte forma: se rítmico e frequência cardíaca (FC) inferior a 70 batimentos por minuto (bpm) – dose máxima apenas aos 70% do intervalo RR; se arrítmico ou rítmico com FC 70‐80bpm – dose máxima de 40 a 80% do intervalo RR; se rítmico e FC superior a 80bpm – dose máxima a 40‐50% do intervalo RR. A kilovoltagem (kV) foi determinada da seguinte forma: 100kV se índice de massa corporal (BMI) <30, caso contrário 120Kv. As imagens foram reconstruídas com protocolo de filtered back projection (FBP), com uma espessura de 1,5mm e um incremento de 0,7mm, matriz 512 x 512. O contraste usado tinha a concentração de 320mgI/ml e foi administrado num protocolo trifásico com um débito de 6ml/seg, da seguinte forma: primeira fase com administração de contraste puro com volume calculado segundo a fórmula: volume de contraste administrado = (tempo de aquisição + tempo de espera) x 6 (valor do fluxo de administração). O tempo de espera foi fixado em sete segundos; segunda fase com a administração de 30ml de contraste diluído (30% contraste e 70% soro); terceira fase com administração de 30ml de soro. Foi usada a técnica de bolus tracking com região de interesse na aorta ascendente e início de aquisição sete segundos após atingir a densidade de 150HU (unidades de Hounsfield).
Protocolo de aquisição para o Grupo 2Exames feitos em TC dupla‐ampola 1.ª geração – 64 detetores – SOMATOM Definition®, com resolução temporal nativa de 83ms e velocidade de mesa (pitch) máximo de 45,7mm/s. Aquisição com protocolo prospetivo se doente rítmico ou arrítmico com pequena variabilidade RR; noutros casos aquisição retrospetiva (modulação da miliamperagem com 20% da miliamperagem fora dos intervalos de dose máxima, com dose máxima de 40 a 80% do intervalo RR). A kV foi determinada da seguinte forma: 80kV se BMI <30, caso contrário 100kV se peso inferior a 100kg e 120kV se peso superior a 100kg.
As imagens foram reconstruídas com protocolo de filtered back projection (FBP), com uma espessura de 1,5mm e um incremento de 0,7mm, matriz 512 x 512. O contraste usado tinha a concentração de 370 mgI/ml e foi administrado num protocolo trifásico com um débito de 5ml/seg, da seguinte forma: primeira fase com administração de contraste puro com volume calculado segundo a fórmula: volume de contraste administrado = (tempo de aquisição + tempo de espera) x 5 (valor do fluxo de administração). O tempo de espera foi fixado em 10 segundos; segunda fase com a administração de 30ml de contraste diluído (30% contraste e 70% soro); terceira fase com administração de 30ml de soro. Foi usada a técnica de bolus tracking com região de interesse na aorta ascendente e início de aquisição 10 segundos após atingir a densidade de 150HU (unidades de Hounsfield).
Protocolo de aquisição para o Grupo 3Exames feitos em TC dupla‐ampola 3.ª geração – 192 detetores – SOMATOM Force®, com resolução temporal nativa de 66 ms e velocidade de mesa (pitch) máximo em modo FLASH de 737mm/seg. Aquisição com protocolo FLASH (aquisição em batimento cardíaco único com método de velocidade de mesa muito elevado 737mm/s), exceto se doentes com FC média superior a 80 bpm, nos quais se opta pela aquisição em método prospetivo. Aquisição retrospetiva apenas em doentes com marcada variabilidade RR. A determinação da kV e da miliamperagem (mA) é efetuada de forma automática, tem em conta a densidade do topograma e os parâmetros de referência, os quais optámos por definir 80kV com 200mAs/rot, com indicação de feitura de angio‐TC. Apenas se BMI>30, os kV de referência passam a 100kV. Os valores de referência servem como um guia para o ruído admissível/máximo que se pretende ter na imagem, faz o aparelho uma modificação dos valores por forma a otimizar a dose de radiação, mantém‐se a qualidade da imagem. As imagens foram reconstruídas com protocolo iterativo – SAFFIRE “força” 3, com 1,5mm de espessura e 0,7mm de incremento, com matriz 512 x 512. O contraste usado tinha a concentração de 370 mgI/ml e foi administrado num protocolo trifásico com um débito de 4ml/seg, da seguinte forma: primeira fase com administração de contraste puro com volume calculado segundo a fórmula: volume de contraste administrado = (tempo de aquisição + tempo de espera) x 4 (valor do fluxo de administração). O tempo de espera foi fixado em 15 segundos (compensa a marcada diminuição do tempo de aquisição que no protocolo FLASH é inferior a 1 segundo); segunda fase com a administração de 30ml de contraste diluído (30% contraste e 70% soro); terceira fase com administração de 30ml de soro.
Foi usada a técnica de bolus tracking com região de interesse na aorta ascendente e início de aquisição 15 segundos após atingir a densidade de 150HU (unidades de Hounsfield).
Avaliámos a otimização do protocolo com base em diversos parâmetros: A) na dose de radiação em mSv, calculada a partir dos DLP (dose lengh product) totais, disponibilizados pelo aparelho, multiplicados pelo fator de conversão 0,01412–14; B) no volume de contraste usado em ml; C) na avaliação subjetiva da qualidade diagnóstica, definida por exame com acuidade diagnóstica para excluir trombo na aurícula esquerda e apêndice auricular esquerdo, avaliada por dois médicos (com nível III de formação em TC cardíaca), de forma independente, bem como pelo número de doentes em que foi considerada necessária uma segunda aquisição, mais tardia (sem nova administração de contraste, para avaliar adequadamente o apêndice auricular esquerdo e permitir a exclusão de trombo); D) na avaliação objetiva da qualidade do exame, efetuada para avaliação da capacidade de otimização do protocolo entre aparelhos diferentes (aplicada ao Grupo 2 e 3), caracterizada pelo rácio sinal/ruído, o rácio contraste/ruído e a homogeneização de densidade entre a AEsq e o AAEsq
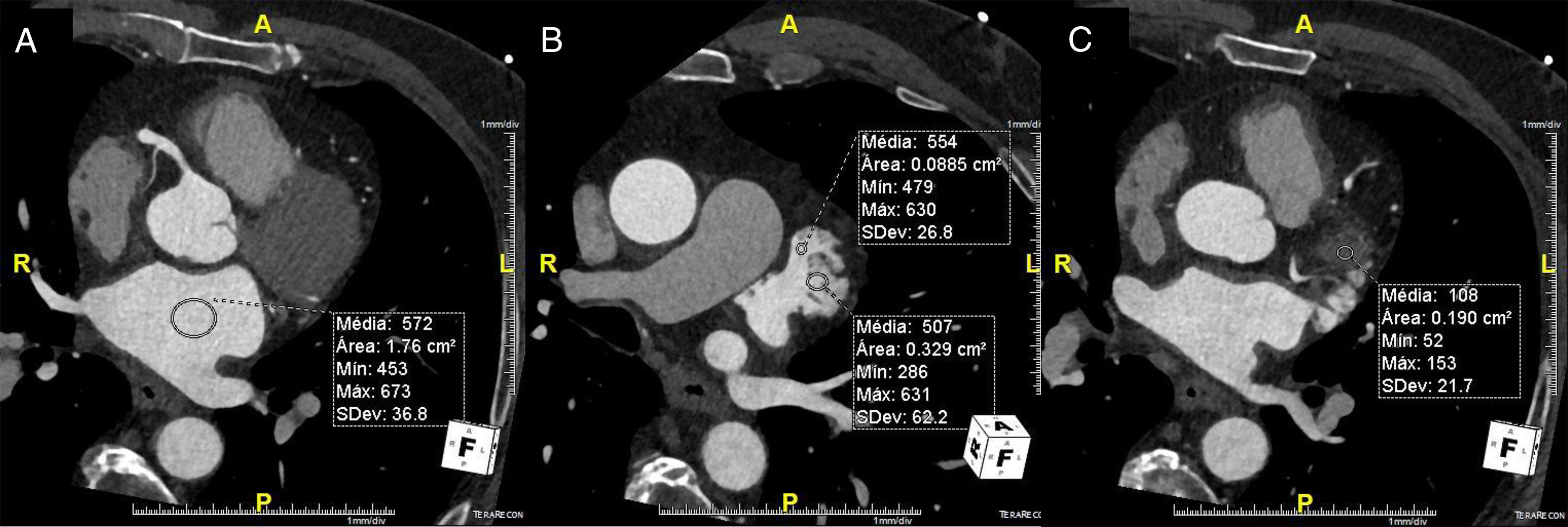
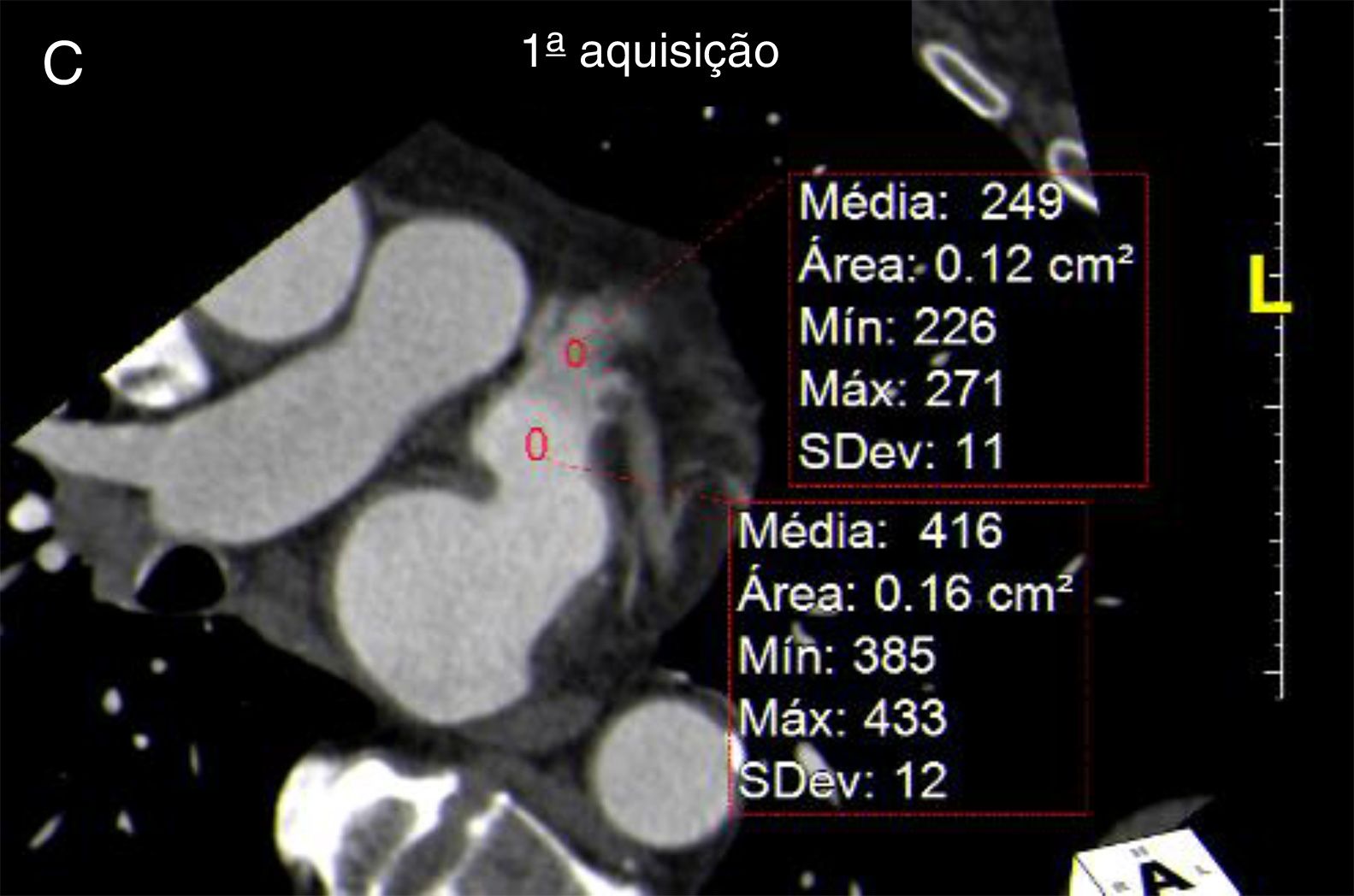
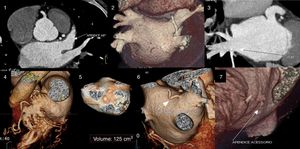
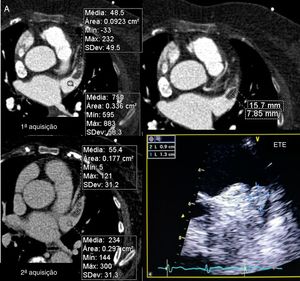
Definição dos parâmetros de avaliação quantitativa da qualidade de imagemO rácio sinal/ruído é obtido por desenho de uma região de interesse no centro da aurícula esquerda e dividindo a densidade média pelo desvio padrão. (Figura 3). Em relação ao rácio contraste/ruído, nesse tipo de exame e tendo em conta a importância de exclusão de trombo, optámos por definir esse parâmetro em relação à densidade do miocárdio do ventrículo esquerdo, e não em relação à gordura epicárdica, uma vez que o miocárdio do ventrículo esquerdo é a estrutura limítrofe com o AAEsq com menor diferença de densidade em relação ao lúmen do mesmo. Para o cálculo desse parâmetro foram desenhadas regiões de interesse no AAEsq (local de menor densidade visual) e intramiocárdico, no segmento do miocárdio em maior proximidade do AAE. O rácio foi obtido da seguinte forma (densidade média do AAEsq – densidade média do miocárdio)/desvio padrão do AAEsq. A homogeneização de densidade entre a AEsq e o AAEsq é obtida pela divisão da densidade média da AEsq obtida na região de interesse desenhada no local visual de maior densidade com a densidade média obtida da região de interesse desenhada no local de menor densidade visual no AAEsq. (Figura 3)
Cálculo dos índices de sinal/ruído e contraste/ruído.
A) Região de interesse (ROI) na AEsq; B) ROI no AAEsq; C) ROI na parede do VEsq.
Cálculo sinal/ruído = Densidade média AEsq/Desvio padrão AEsq.
Cálculo contraste/ruído = (densidade média AAEsq‐densidade média da parede Vesq)/Desvio padrão AAEsq.
Avaliação da homogenização de contraste AEsq/AAEsq = Densidade média AEsq/Densidade média da área de menor densidade no AAEsq.
Dentro de cada grupo foram ainda registadas características demográficas (género, idade, peso, altura), bem como o ritmo cardíaco e a frequência cardíaca (máxima, mínima e média) durante a aquisição, variáveis do protocolo usado (retrospetivo, prospectivo, flash; kV da aquisição; DLP do exame), o volume auricular, a presença de trombo intracardíaco e a presença de complicações tromboembólicas após o procedimento de ablação até à alta clínica. Todos os exames foram efetuados com sincronização com ECG, procurou‐se otimizar os parâmetros do protocolo ao doente.
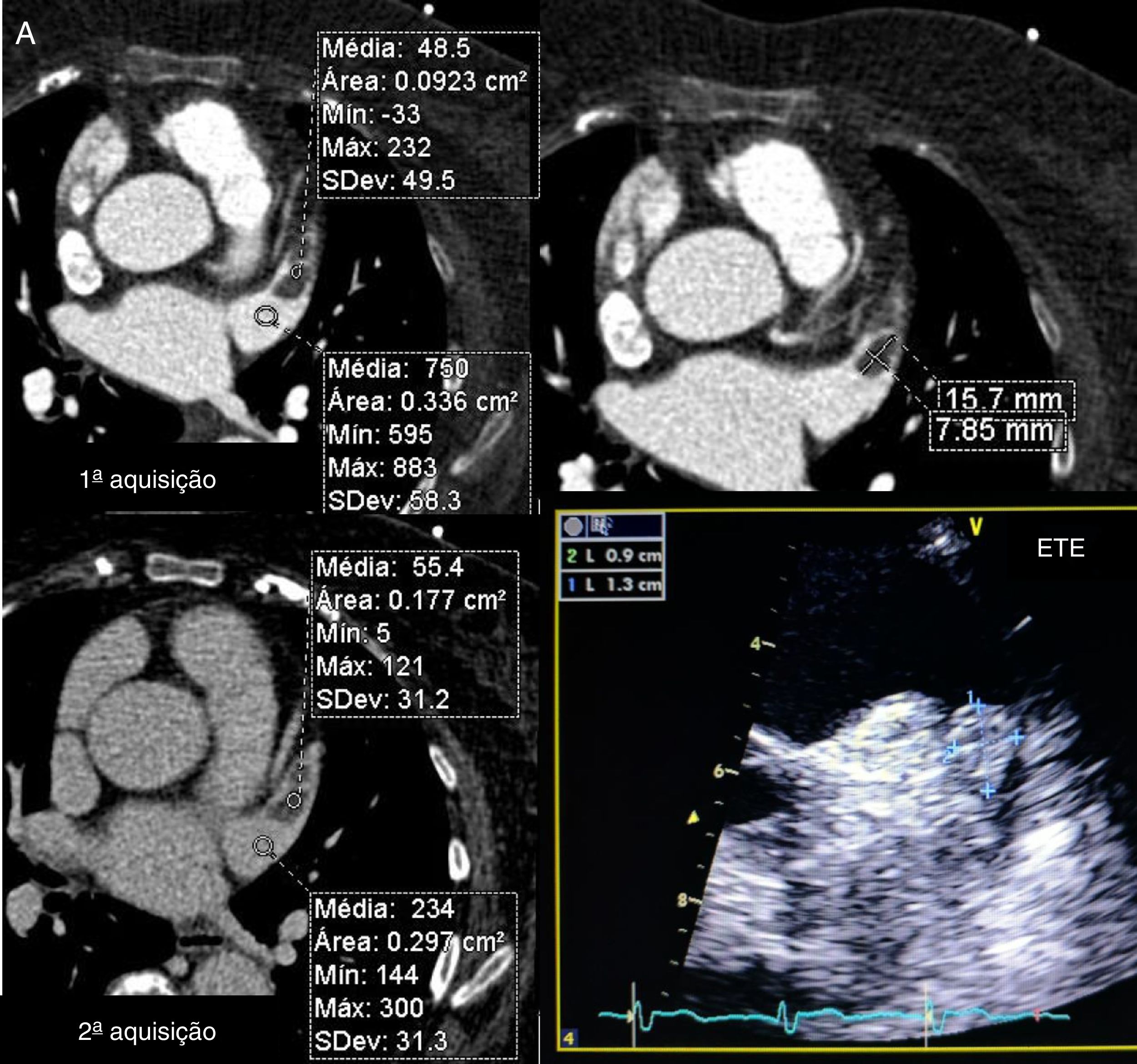
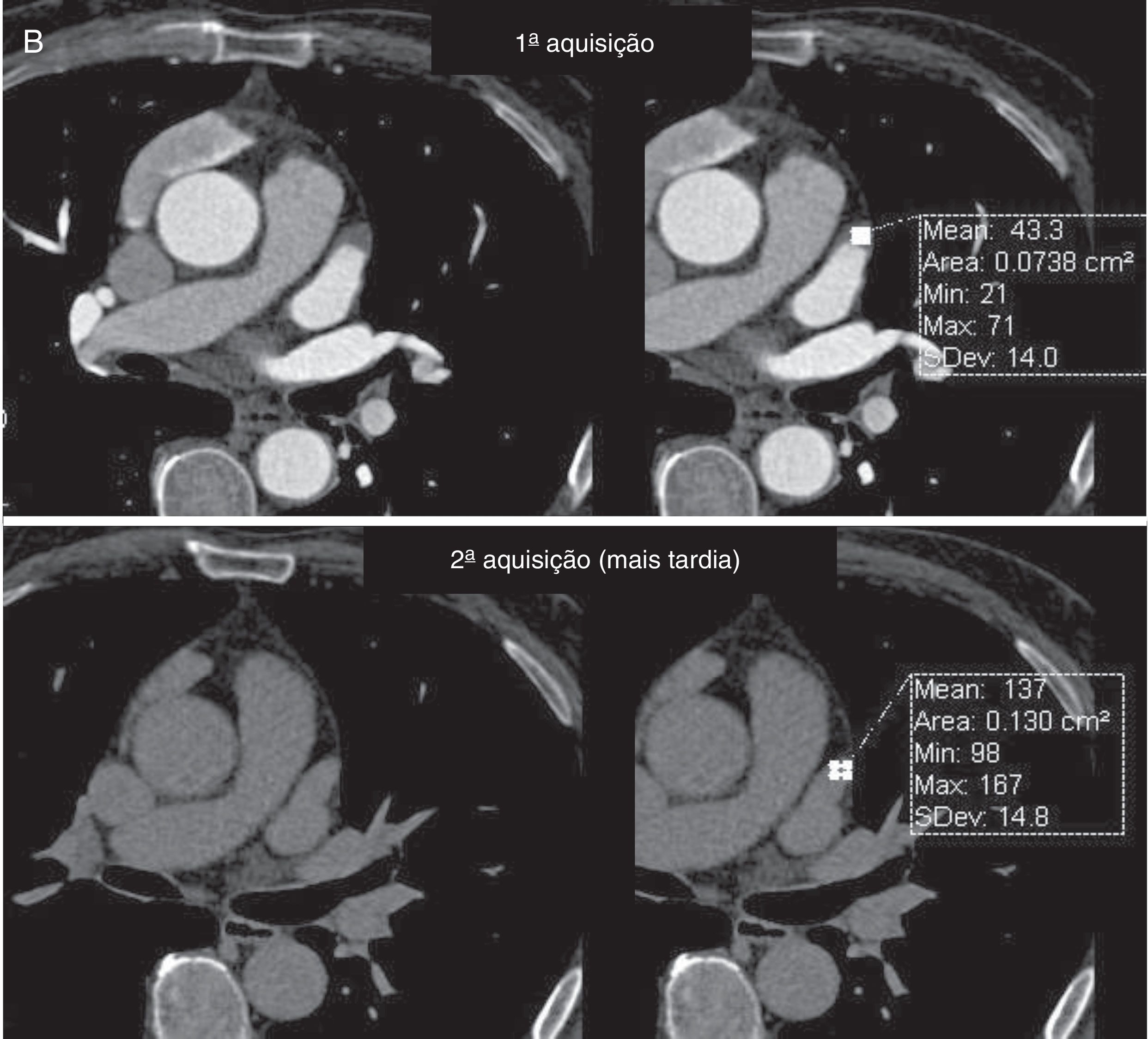
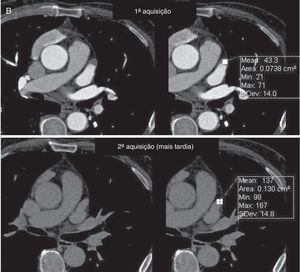
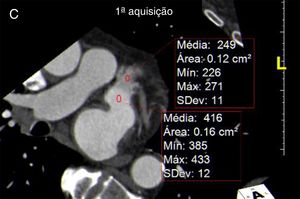
Os exames foram avaliados logo após a sua feitura para decisão de necessidade de aquisição complementar (2.ª aquisição) quando a opacificação do AAESq era determinada insuficiente para exclusão segura de trombo ou quando, por qualquer outra causa, o exame era considerado não diagnóstico. Essa segunda aquisição era efetuada nos primeiros três minutos após a aquisição inicial, sem usar mais contraste e limitada ao AAEsq (Figuras 4‐5).
As variáveis contínuas apresentam‐se como mediana (intervalo interquartil) e as categóricas como número (n) e frequência (%). Para comparação entre variáveis contínuas usaram‐se os testes não paramétricos de Mann‐Whitney ou Kruskal‐Wallis. O teste exato de Fisher foi usado para testar diferenças nas frequências de variáveis categóricas. Foi usado o software Statistical Pack for Social Sciences (IBM SPSS) versão 20 para Mac OSX. Aceitou‐se existir diferença significativa quando p<0,05 (duas caudas).
ResultadosOs resultados da avaliação dos três grupos e da comparação entre grupos são apresentados na Tabela 1.
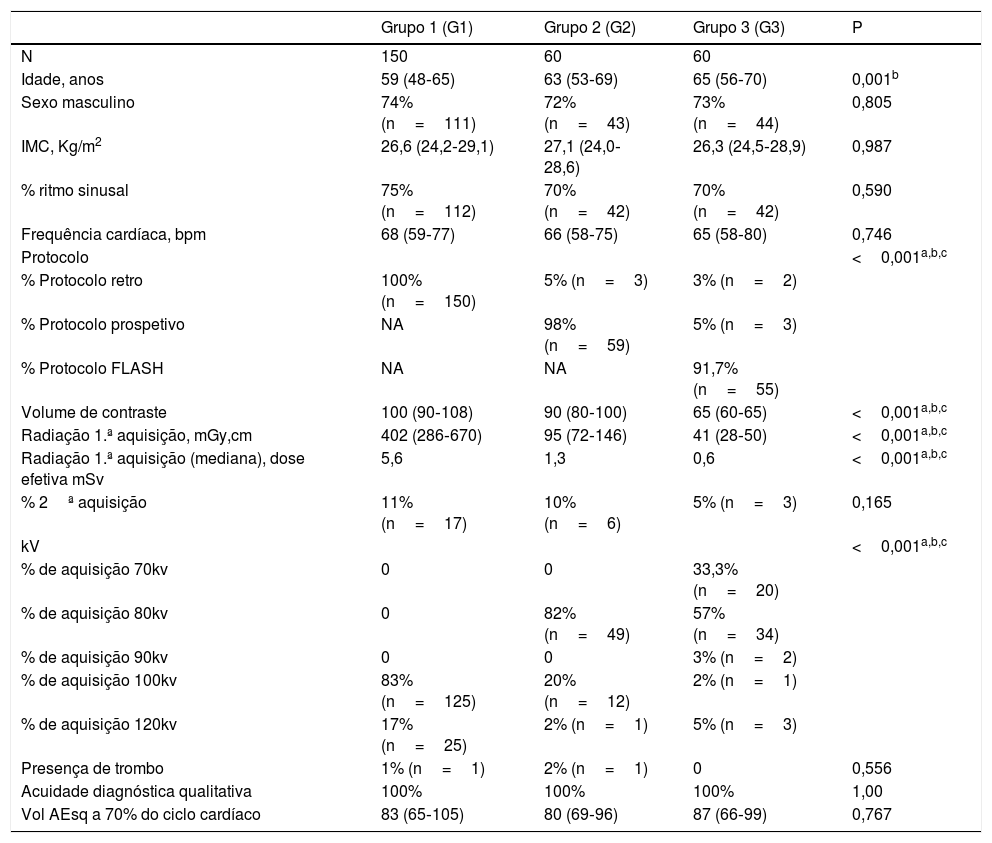
Descrição dos grupos e avaliação comparativa
| Grupo 1 (G1) | Grupo 2 (G2) | Grupo 3 (G3) | P | |
|---|---|---|---|---|
| N | 150 | 60 | 60 | |
| Idade, anos | 59 (48‐65) | 63 (53‐69) | 65 (56‐70) | 0,001b |
| Sexo masculino | 74% (n=111) | 72% (n=43) | 73% (n=44) | 0,805 |
| IMC, Kg/m2 | 26,6 (24,2‐29,1) | 27,1 (24,0‐28,6) | 26,3 (24,5‐28,9) | 0,987 |
| % ritmo sinusal | 75% (n=112) | 70% (n=42) | 70% (n=42) | 0,590 |
| Frequência cardíaca, bpm | 68 (59‐77) | 66 (58‐75) | 65 (58‐80) | 0,746 |
| Protocolo | <0,001a,b,c | |||
| % Protocolo retro | 100% (n=150) | 5% (n=3) | 3% (n=2) | |
| % Protocolo prospetivo | NA | 98% (n=59) | 5% (n=3) | |
| % Protocolo FLASH | NA | NA | 91,7% (n=55) | |
| Volume de contraste | 100 (90‐108) | 90 (80‐100) | 65 (60‐65) | <0,001a,b,c |
| Radiação 1.ª aquisição, mGy,cm | 402 (286‐670) | 95 (72‐146) | 41 (28‐50) | <0,001a,b,c |
| Radiação 1.ª aquisição (mediana), dose efetiva mSv | 5,6 | 1,3 | 0,6 | <0,001a,b,c |
| % 2ª aquisição | 11% (n=17) | 10% (n=6) | 5% (n=3) | 0,165 |
| kV | <0,001a,b,c | |||
| % de aquisição 70kv | 0 | 0 | 33,3% (n=20) | |
| % de aquisição 80kv | 0 | 82% (n=49) | 57% (n=34) | |
| % de aquisição 90kv | 0 | 0 | 3% (n=2) | |
| % de aquisição 100kv | 83% (n=125) | 20% (n=12) | 2% (n=1) | |
| % de aquisição 120kv | 17% (n=25) | 2% (n=1) | 5% (n=3) | |
| Presença de trombo | 1% (n=1) | 2% (n=1) | 0 | 0,556 |
| Acuidade diagnóstica qualitativa | 100% | 100% | 100% | 1,00 |
| Vol AEsq a 70% do ciclo cardíaco | 83 (65‐105) | 80 (69‐96) | 87 (66‐99) | 0,767 |
AE – aurícula esquerda; FLASH – protocolo de aquisição num só batimento cardíaco com velocidade de mesa muito rápida; IMC – Índice de massa corporal; kV – quilovoltagem.
Os exames do Grupo 1 tiveram radiação mediana de 5,6mSv (402DLP dose lengh product x 0,014), os do Grupo 2 – 1,3mSv (95DLP x 0,014) e 0,6mSv para os doentes do Grupo 3 (41DLP x 0,014). Salientamos a diferença significativa no tipo de protocolo usado e na kV dos exames, aspeto que contribui decisivamente para a diferença significativa na mediana da dose de radiação dos exames.
Dose de contrasteA evolução do protocolo permitiu ainda uma redução significativa entre os grupos da dose de contraste, dos 100ml de volume no Grupo 1 para os 65ml usados no grupo 3.
Avaliação qualitativa da imagemTodos os exames foram considerados diagnósticos. Apesar de não ter atingido significância, existe uma tendência para a menor necessidade de 2.ª aquisição com o evoluir do protocolo, com percentagem de 2.ª aquisições de 11% no Grupo 1 (desses 17 casos apenas num caso a área de menor densidade traduzia imagem “correcta” dado corresponder a verdadeiro trombo, confirmado por ecocardiografia transesofágica) (Figuras 4‐6) e de apenas 5% no grupo 3 (p = 0,057).
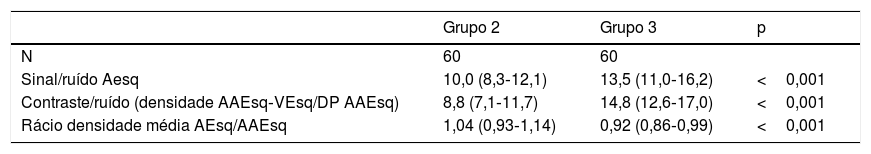
Avaliação quantitativa da qualidade da imagemNa avaliação quantitativa da qualidade de imagem (Tabela 2) entre o Grupo
Avaliação quantitativa da qualidade de imagem
| Grupo 2 | Grupo 3 | p | |
|---|---|---|---|
| N | 60 | 60 | |
| Sinal/ruído Aesq | 10,0 (8,3‐12,1) | 13,5 (11,0‐16,2) | <0,001 |
| Contraste/ruído (densidade AAEsq‐VEsq/DP AAEsq) | 8,8 (7,1‐11,7) | 14,8 (12,6‐17,0) | <0,001 |
| Rácio densidade média AEsq/AAEsq | 1,04 (0,93‐1,14) | 0,92 (0,86‐0,99) | <0,001 |
AAEsq – apêndice auricular esquerdo; AEsq – aurícula esquerda; VEsq – ventrículo esquerdo,
2 e o Grupo 3, verificamos que apesar da redução da dose de radiação e do volume de contraste, os exames apresentaram melhor qualidade com rácios sinal/ruído e contraste/ruído significativamente maiores e com maior homogeneização de densidade entre a AEsq e o AAEsq.
Na tabela 3 verificamos que a necessidade de 2.ª aquisição não se correlacionou com o volume auricular (apesar parecer existir uma tendência para ser necessária em aurículas maiores, p = 0,087), mas apenas com a aquisição em fibrilhação auricular e com a frequência cardíaca média durante a aquisição.
Fatores preditores de 2.ª aquisição
| 2.ª Aquisição | |||
|---|---|---|---|
| Sim (n=26) | Não (n=244) | p | |
| Idade, anos | 60 (53‐67) | 61 (51‐67) | 0,836 |
| Sexo masculino | 73% (n=19) | 73% (n=178) | 1,000 |
| IMC, Kg/m2 | 27,9 (24,1‐30,1) | 26,5 (24,4‐29,1) | 0,455 |
| % ritmo sinusal | 50% (n=13) | 75% (n=183) | 0,011 |
| FC média, bpm | 73 (65‐89) | 66 (58‐77) | 0,039 |
| Protocolo | 0,381 | ||
| % Protocolo Retrospetivo | 65,4% (n=17) | 52,5% (n=128) | |
| % protocolo prospetivo | 26,9% (n=7) | 26,2% (n=64) | |
| % protocolo FLASH | 7,7% (n=2) | 21,3% (n=52) | |
| Volume de contraste, mL | 95 (80‐103) | 90 (65‐102) | 0,397 |
| Volume AE a 70% do ciclo cardíaco | 93 (70‐118) | 82 (67‐99) | 0,087 |
AE – aurícula esquerda; FLASH: protocolo de aquisição num só batimento cardíaco com velocidade de mesa muito rápida; IMC: Índice de massa corporal.
A TC cardíaca num contexto prévio a ablação de fibrilhação auricular permite dispensar outros métodos de imagem, é capaz de fornecer um excelente mapa anatómico e excluir a presença de trombos intracardíacos9,15. No entanto, para que a presença de falsos positivos não diminua a acuidade da técnica e consequentemente o seu valor como “exame único” prévio à técnica ablativa, é necessário diferenciar trombos verdadeiros de imagens referidas como pseudotrombos, que não são infrequentes e resultam de insuficiente homogeneização contraste‐sangue entre a AEsq e o AAEsq16. Existem diferentes formas de diferenciar essas entidades, optámos por avaliar sempre as imagens da primeira aquisição logo após a sua reconstrução e caso a homogeneização de densidade AEsq/AAEsq não permitisse a exclusão de trombo, repetimos a aquisição limitada ao AAEsq sem mais contraste, dentro de um período temporal de três minutos após a primeira aquisição. Para diminuir a necessidade de 2.ª aquisições, que são infrequentes (11% no Grupo 1 e 5% no Grupo 3), atrasámos o início da aquisição inicial aumentando o valor de densidade para início de aquisição (trigger) no bolus tracking, assim como o tempo de espera entre esse trigger e o início da aquisição propriamente dita. Apesar de essas modificações de protocolo não terem resultado numa diminuição significativa do número de 2.ª aquisições necessárias, parece existir uma tendência nesse sentido (de 11% no Grupo 1 para 5% no Grupo 3, p=0,057). Verificamos que a necessidade de 2.ª aquisição se correlacionou com a aquisição em fibrilhação auricular e com a frequência cardíaca média durante a aquisição, mas não com o volume auricular (apesar parecer existir uma tendência para ser necessária em aurículas maiores, p=0,087). Esses aspetos estão de acordo com os fatores preditores de defeitos de preenchimento por contraste do AAEsq em TC cardíaca, identificados por outros autores. Na série de Singh et al.17 a dilatação da aurícula esquerda estava relacionada com defeitos de preenchimento da AAEsq na angio‐TC. No trabalho de Madan et al.18 verificou‐se que os defeitos de preenchimento do AAEsq na TC se relacionaram com FA permanente, após análise multivariada a presença de FA durante a aquisição e a idade foram preditores independentes desses defeitos. O timing da aquisição do nosso protocolo procura, para além de diminuir a necessidade de segundas passagens, otimizar a qualidade de imagem e manter bons rácios de sinal/ruído e contraste/ruído, sem aumentar a dose de contraste ou a dose de radiação final. Esse aspeto foi conseguido com doses de contraste e radiação significativamente menores (p<0,001). Já anteriormente o nosso grupo publicou que a aquisição em fibrilação auricular era um preditor de maior dose de radiação, pelo que se torna ainda mais relevante a adoção de protocolos que visam reduzir a sua dose, sobretudo em doentes que com frequência necessitam de vários exames seriados com radiação ionizante ao longo da sua vida19,20. Salientamos ainda que a comparação quantitativa da qualidade de imagem entre os dois aparelhos de TC foi traduzida por uma melhoria da qualidade de imagem apesar da redução da radiação e contraste. Acresce também que todos os exames foram considerados com acuidade diagnóstica para exclusão de trombo, de forma independente, por um radiologista e um cardiologista com larga experiência em TC cardíaca, apesar dos 17% de casos (74 exames) feitos em FA. Nos exames feitos em FA a reconstrução em tempo absoluto (em milissegundos) imediatamente após a onda T permite “retirar” da imagem os artefactos condicionados pela arritmia, quando a reconstrução é feita em tempo relativo (percentagem do intervalo RR), obtêm‐se desse modo imagens com acuidade diagnóstica.
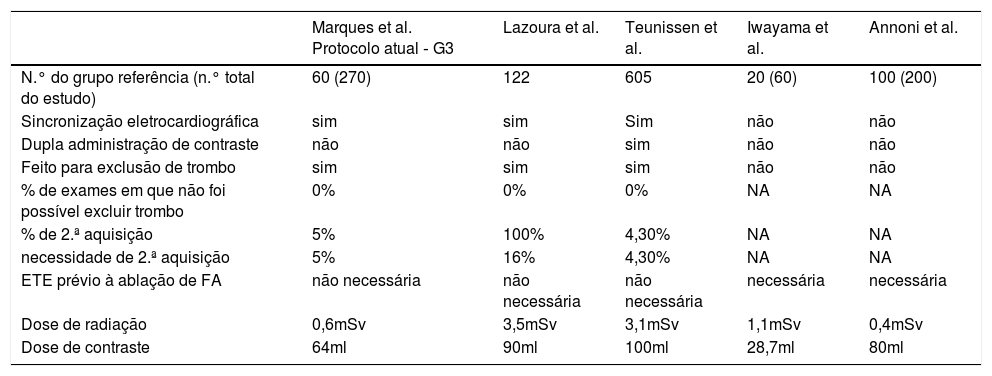
Como referido anteriormente, existem outras formas de procurar otimizar esses protocolos, nomeadamente: A) Com protocolo de dupla aquisição, incluindo sempre aquisição tardia, como efectuado por Lazoura et al.21, que estudaram 122 doentes, com 16% de defeitos de repleção do AAEsq na primeira aquisição, dos quais todos foram diagnóstico na segunda aquisição (como na nossa série), identificaram‐se cerca de 3% de trombos. Neste artigo, verifica‐se ainda que a necessidade de segunda passagem avaliada através da percentagem de defeitos de repleção do AAEsq era de apenas 16% (5% no Grupo 3 do nosso estudo), pelo que a decisão de segunda aquisição apenas se necessário, como efetuado no nosso estudo, parece‐nos a mais acertada. Comparativamente com o nosso estudo, a dose de contraste e radiação foi superior. B) Com protocolo de dupla injecção de contraste e apenas adquirindo uma vez, após a segunda administração, como efetuado por Teunissen et al.22, que estudaram 605 doentes, com doses médias de contraste de 100ml e de radiação de 3,1mSv. A percentagem de necessidade de segunda aquisição foi de 4,3%. Comparativamente com o nosso estudo, esse protocolo obteve resultados semelhantes na necessidade de 2.ªs aquisições, mas à custa de maiores doses de contraste e radiação. C) Protocolo sem sincronização eletrocardiográfica, como o feito por Iwayama et al.23, que estudaram 60 doentes, mas não avaliaram a presença de trombo. Obtiveram dose de radiação média de 1,1mSv. No entanto, a não exclusão de trombo nesse protocolo não permite a dispensa de ecocardiograma transesofágico (ETE), o que acresce custo e fonte de morbilidade aos doentes. Mesmo fazendo o exame sem sincronização eletrocardiográfica, a dose de radiação foi superior à usada no nosso estudo. Noutro estudo, igualmente com exames feitos sem sincronização eletrocardiográfica, Annoni et al.24 estudaram 200 doentes, 100 dos quais no grupo de menor dose de radiação. Não avaliaram a presença de trombo e obtiveram uma dose de radiação média de 0,4mSv. Tal como no estudo de Iwayama, a não exclusão de trombo não dispensa a ETE. Salientamos que a dose de radiação do estudo de Annoni et al. é a mais reduzida, com valores médios de 0,4mSv (valores semelhantes aos usados no Grupo 3 do nosso estudo – 0,6mSv) (Tabela 4).
Comparação com outras publicações
| Marques et al. Protocolo atual ‐ G3 | Lazoura et al. | Teunissen et al. | Iwayama et al. | Annoni et al. | |
|---|---|---|---|---|---|
| N.° do grupo referência (n.° total do estudo) | 60 (270) | 122 | 605 | 20 (60) | 100 (200) |
| Sincronização eletrocardiográfica | sim | sim | Sim | não | não |
| Dupla administração de contraste | não | não | sim | não | não |
| Feito para exclusão de trombo | sim | sim | sim | não | não |
| % de exames em que não foi possível excluir trombo | 0% | 0% | 0% | NA | NA |
| % de 2.ª aquisição | 5% | 100% | 4,30% | NA | NA |
| necessidade de 2.ª aquisição | 5% | 16% | 4,30% | NA | NA |
| ETE prévio à ablação de FA | não necessária | não necessária | não necessária | necessária | necessária |
| Dose de radiação | 0,6mSv | 3,5mSv | 3,1mSv | 1,1mSv | 0,4mSv |
| Dose de contraste | 64ml | 90ml | 100ml | 28,7ml | 80ml |
ETE – ecocardiograma transesofágico; FA – fibrilhação auricular; mSv – milisievert.
A prevalência de trombos identificada antes de ablação de fibrilação auricular é muito variável. Numa metanálise que comparou diferentes estudos que usaram angio‐TC e ETE, a prevalência variou entre 20,6% (13 trombos em 63 doentes) e 1,3% (três trombos em 223 doentes)25. Numa série mais recente, Teunissen et al.20 identificaram apenas dois trombos em 605 doentes, o que correspondeu a uma prevalência de apenas 0,3%. Tal como no estudo de Teunissen et al., a nossa prevalência de trombos foi baixa (cerca de 1%), o que poderá dever‐se à população de doentes de menor risco, com seguimento médico regular e maior taxa de hipocoagulação.
Consideramos que, face aos resultados apresentados, esse protocolo de TC num contexto prévio a ablação de FA, como exame único, representa um protocolo com menor dose de radiação, sem sacrifício da qualidade conforme confirmado pela avaliação quantitativa da qualidade da imagem.
LimitaçõesComo possíveis limitações deste estudo, salientamos: A) Não foi feito ecocardiograma transesofágico sistemático em todos os doentes, mas apenas para confirmação dos trombos identificados na TC cardíaca. No entanto, apesar de poder ser considerada uma limitação, a acuidade para excluir trombo da TC cardíaca é muito elevada e quando acompanhada de aquisição tardia o número de falsos positivos é igualmente muito baixo9; B) Entre o Grupo 1 e o Grupo 2 houve uma mudança na concentração de iodo do contraste usado (320 para 370mgI/ml), mas que foi compensada pelo menor fluxo de administração do mesmo no grupo 2; C) a nossa série apresenta um número reduzido de trombos, mas esse aspeto é uma característica frequente na população que faz exame de TC pré‐ablação de FA, é ainda possível fator contributivo o facto de se tratar de doentes eletivos, com seguimento médico regular e maior taxa de hipocoagulação; D) apenas foi avaliada quantitativamente a qualidade da imagem do Grupo 2 e 3, dado ter coincidido com a introdução de uma tecnologia nova. Houve avaliação subjetiva da qualidade de imagem em todos os grupos; E) Não testámos um protocolo sem sincronização eletrocardiográfica, que poderia estar associado a menor dose de radiação24. No entanto, em aquisição em modo FLASH, a redução de dose não deveria ser significativa. Além disso a acuidade para exclusão de trombo não foi ainda estabelecida, o que limitaria a sua adoção como exame único prévio à ablação.
ConclusõesA otimização de protocolos e a evolução tecnológica permitiram reduções significativas nas doses de contraste e de radiação (para valores submilisiviert) na TC cardíaca pré‐ablação de fibrilhação auricular, sem diminuição da qualidade de imagem.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.