A síndrome de Brugada, descrita há cerca de 20 anos, caracteriza‐se eletrocardiograficamente por uma elevação convexa do segmento‐ST nas derivações precordiais direitas e pelo elevado risco de morte súbita em jovens aparentemente saudáveis.
Este padrão eletrocardiográfico é, por vezes, intermitente, sendo a febre um possível fator precipitante. Os autores apresentam o caso clínico de uma doente de 68 anos que recorre ao serviço de urgência por febre e síncope. Feito o diagnóstico de pneumonia adquirida na comunidade. O eletrocardiograma realizado em contexto de febre revelou um padrão de Brugada tipo 1, que desapareceu após resolução do quadro febril. Excluídas outras causas de padrão Brugada‐like foi confirmado o diagnóstico de síndrome de Brugada e realizada implantação de cardioversor‐desfibrilhador.
Este caso ilustra a possibilidade do diagnóstico desta entidade poder ser feito numa faixa etária já avançada e reforça a utilidade da realização de um eletrocardiograma em contexto febril.
Brugada syndrome, first described over 20 years ago, is characterized by a typical electrocardiographic pattern with coved‐type ST‐segment elevation in the right precordial leads and a high risk of sudden death in otherwise healthy young adults.
The electrocardiographic pattern is sometimes intermittent, and fever is a possible trigger. The authors present the case of a 68‐year‐old woman who came to the emergency department with fever and syncope. A diagnosis of community‐acquired pneumonia was made. The electrocardiogram performed when the patient had fever revealed a type 1 Brugada pattern, which disappeared after the fever subsided. After other causes of Brugada‐like pattern were excluded, Brugada syndrome was diagnosed and a cardioverter‐defibrillator was implanted.
This case demonstrates that this entity can be diagnosed at more advanced ages and highlights the usefulness of electrocardiography in a febrile state.
A síndrome de Brugada (SBr), descrita como entidade clínica em 19921, é uma doença autossómica dominante, associada a um elevado risco de morte súbita em doentes jovens aparentemente saudáveis2.
Trata‐se de uma síndrome rara, com uma prevalência estimada de 5/10 000 habitantes, que atinge os dois sexos, mas é cerca de oito vezes mais prevalente no género masculino2. Caracteriza‐se eletrocardiograficamente por uma elevação convexa, em rampa descendente, do segmento‐ST nas derivações precordiais direitas (V1‐3)2. Apesar de o padrão eletrocardiográfico típico, o facto de ser, por vezes, intermitente, dificulta o diagnóstico. A febre é um fator desencadeante já descrito3.
Os autores apresentam o caso clínico de uma doente com o diagnóstico de SBr realizado durante uma síndrome febril.
Caso clínicoDoente do sexo feminino, 68 anos, com antecedentes de hipertensão arterial, dislipidemia e tabagismo, medicada em ambulatório com amlodipina, indapamida e rosuvastatina. Recorre ao serviço de urgência por febre com um dia de evolução, dor na face anterior do hemitórax direito, de características pleuríticas, com irradiação dorsal, tosse não produtiva e um episódio de perda de consciência, sem pródromos, de curta duração e recuperação espontânea, sem período pós‐crítico. A doente não apresentava história de episódios sincopais prévios, respiração noturna agónica ou antecedentes familiares de morte súbita.
À admissão apresentava‐se subfebril (37,4°C) e hemodinamicamente estável (pressão arterial 130/65mmHg e frequência cardíaca 88bpm). Ao exame objetivo não foram encontradas alterações à auscultação cardíaca e pulmonar, nem sinais indiretos de trombose venosa profunda.
Analiticamente objetivou‐se aumento dos parâmetros inflamatórios (leucócitos 16.800x103/μL e proteína C reativa 19,6mg/dL), sem elevação dos D‐dímeros ou troponina I. A radiografia de tórax evidenciava uma opacidade alveolar, arredondada, na metade inferior do campo pulmonar direito.
Perante a clínica, as alterações analíticas e imagiológicas foi iniciada antibioterapia empírica para pneumonia adquirida na comunidade com amoxicilina/ácido clavulânico e azitromicina.
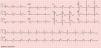
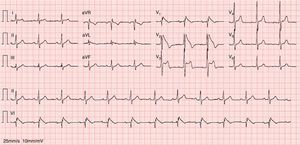
Realizado eletrocardiograma (ECG) para investigação do episódio de perda de consciência, que revelou bloqueio auriculoventricular de primeiro grau, padrão de bloqueio incompleto de ramo direito (BIRD) e elevação do segmento ST em rampa descendente em V1‐V2 e horizontal em V3, acompanhada de inversão da onda T (Figura 1).
O diagnóstico de síndrome coronária aguda foi excluído, apesar de os múltiplos fatores de risco cardiovascular, pois a dor era de características não anginosas e a doente não apresentou elevação dos marcadores de necrose miocárdica em avaliações seriadas. A hipótese de tromboembolia pulmonar sugerida pela clínica foi excluída pelo doseamento normal de D‐dímeros.
Assumiu‐se então o diagnóstico de SBr (padrão eletrocardiográfico tipo 1 induzido por febre e episódio de síncope) e a doente foi internada na unidade de cuidados intensivos cardíacos (UCIC) para vigilância de perfil disrítmico.
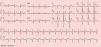
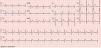
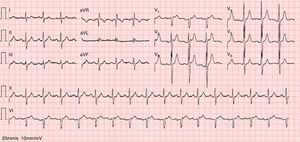
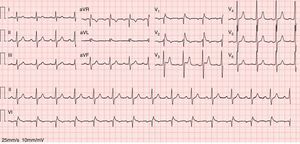
Com a resolução do quadro infecioso o ECG clássico evoluiu para um padrão de Brugada tipo 3 (Figura 2). Contudo, o ECG realizado com as derivações V1 e V2 colocadas no terceiro espaço intercostal continuou a revelar um padrão de Brugada tipo 1 (Figura 3).
Durante a permanência na UCIC não se registaram eventos disrítmicos.
Realizado ecocardiograma transtorácico que excluiu cardiopatia estrutural e funcional. Perante o diagnóstico definitivo de SBr, em doente com síncope, foi realizada implantação de cardioversor‐desfibrilhador implantável (CDI), de acordo com as normas da Sociedade Europeia de Cardiologia (indicação classe IIa)4.
A doente foi referenciada para consulta de genética, não tendo sido identificada qualquer mutação no estudo genético efetuado. A senhora tem dois filhos, assintomáticos, com ECG normal.
No seguimento da consulta de CDI (36 meses) ainda não foram detetados eventos disrítmicos.
DiscussãoA SBr é uma canalopatia hereditária, com transmissão autossómica dominante e penetrância incompleta (aproximadamente 16%, mas variável entre diferentes famílias)5. Trata‐se de uma causa relativamente frequente de morte súbita (4% do global), sendo responsável por 20% das mortes em indivíduos sem cardiopatia estrutural6. O fenótipo clínico é oito vezes mais comum em homens do que em mulheres7. O primeiro evento disrítmico ocorre em média aos 40 anos7.
O nosso caso clínico apresenta aspetos atípicos, pois a primeira manifestação clínica (síncope) ocorreu na sétima década de vida, numa doente do sexo feminino.
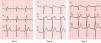
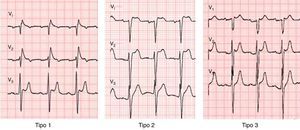
O diagnóstico de SBr implica sempre a presença de um padrão eletrocardiográfico típico: elevação convexa do segmento ST ≥2mm, seguida de uma onda T negativa, em mais do que uma derivação precordial direita (padrão tipo 1)2. Nos indivíduos com padrão tipo 2 (elevação do segmento ST em sela, com porção inicial ≥2mm e final ≥1mm, seguida de onda T positiva ou bifásica) e padrão tipo 3 (elevação do segmento ST em sela, com porção inicial ≥2mm e final <1mm, seguida de onda T positiva) o diagnóstico poderá ser feito quando o padrão tipo 1 é induzido com o teste de provocação com ajmalina ou flecainida (Figura 4)2. A classificação do padrão eletrocardiográfico de Brugada em três tipos tem sido criticada, recomendando‐se atualmente uma divisão em tipo 1 e tipo 2, sendo que o último engloba os padrões eletrocardiográficos tipo 2 e 38.
O diagnóstico de SBr exige, além de um padrão eletrocardiográfico tipo 1 (espontâneo ou induzido), uma das seguintes condições: fibrilhação ventricular (FV) ou taquicardia ventricular (TV) polimórfica documentada, história familiar de morte súbita em indivíduos com menos de 45 anos de idade, ECG típico em familiares, TV induzida por estimulação elétrica programada, síncope ou respiração noturna agónica2.
O padrão eletrocardiográfico tipo 1 apresenta, por vezes, um carácter intermitente, dificultando o diagnóstico. Contudo, pode ser desencadeado por diversos fatores, nomeadamente febre, fármacos e alterações iónicas que interfiram com a dinâmica das correntes de sódio cardíacas9. De sublinhar que 51% dos doentes com SBr apresentam flutuações entre ECG diagnóstico e não diagnóstico10. Um teste de provocação com ajmalina ou flecainida poderá ser utilizado para evidenciar o padrão eletrocardiográfico tipo 1 em caso de suspeita diagnóstica11. Realça‐se que 32% dos doentes com um teste de provocação negativo com a flecainida têm um resultado positivo com a ajmalina, devendo esta ser preferencialmente usada11. Este carácter intermitente foi observado na nossa doente, que inicialmente apresentava um padrão típico no contexto de síndrome febril e que após a resolução do quadro infecioso e em apirexia passou a apresentar um ECG com padrão tipo 3. De salientar que a realização do ECG com as derivações V1 e V2 colocadas no terceiro espaço intercostal revelou um padrão tipo 1, o que aponta para a utilidade deste procedimento em doentes com alta suspeita de SBr, uma vez que aumenta a sensibilidade diagnóstica de 15 para 52%2,7,12. A febre é reconhecida como um fator que, para além de desmascarar o padrão eletrocardiográfico tipo 1, pode desencadear episódios de TV e FV13. Encontra‐se descrito na literatura que o padrão de Brugada tipo 1 pode ser até 20 vezes mais comum em doentes com febre14. Numa grande série de doentes com SBr, a febre foi o fator precipitante de disritmia ventricular em 18% dos casos15. Além disso, está relatado que em doentes com teste de flecainida negativo, a febre pode desmascarar um padrão tipo 116. Porém, não se sabe ainda se tal ocorre também em doentes com teste de ajmalina negativo. Assim, sugere‐se a realização, sempre que possível, de ECG em contexto de febre, a todos os doentes com suspeita de SBr, independentemente do resultado do teste de provocação com fármacos16.
Na SBr existe um desequilíbrio de correntes iónicas no final da fase 1 do potencial de ação a favor da repolarização, por uma diminuição da atividade dos canais de sódio (INa), o que resulta numa atividade das correntes de repolarização (canais de potássio, Ito) sem oposição ou com oposição diminuída das correntes despolarizantes. Estas alterações são mais marcadas em zonas com maior densidade de canais Ito (epicárdio do ventrículo direito), o que leva a uma dispersão transmural de potenciais de ação, pois há áreas com perda do dome do potencial de ação e outras nas quais o potencial de ação é normal. Assim, surge um período vulnerável, em que o potencial de ação pode propagar‐se de zonas com repolarização normal, para zonas com repolarização precoce, criando‐se o substrato para uma re‐excitação via mecanismo de reentrada de fase 2, o que facilita o desenvolvimento de extrassístoles ventriculares. Estas podem iniciar um circuito de reentrada e, consequentemente, fenómenos de TV/FV9,17,18.
Keller et al. demonstraram que os canais de sódio mutados apresentam uma perda de função severa a absoluta a temperaturas fisiológicas, logo não pode ser esperado o aumento da perda de função destes canais durante a febre3. Os canais de sódio não mutados (wild type) também são sensíveis a alterações da temperatura, com diminuição da sua atividade a temperaturas mais elevadas. Assim, em indivíduos heterozigotos, a inativação acelerada dos canais de sódio wild type é a responsável pelas arritmias induzidas pela febre. Desta forma, em indivíduos geneticamente suscetíveis, esta pequena perda adicional de correntes de sódio altera o ténue equilíbrio entre as correntes INa e Ito, conduzindo a uma heterogeneidade transmural de potenciais de ação, devido à repolarização precoce em zonas com maior concentração de canais Ito (diminuição da oposição das correntes de sódio). Assim, estabelece‐se o substrato necessário para uma reentrada de fase 2, o que pode resultar em episódios de TV/VF3,14,19,20. É também plausível que alterações dependentes da temperatura afetem outras correntes iónicas, podendo por exemplo intensificar a corrente Ito, precipitando assim a repolarização precoce do tecido epicárdico onde existe uma maior densidade destes canais17.
A estratificação de risco em doentes com SBr é um tema controverso, com publicações divergentes. No nosso caso clínico a decisão de implantar CDI foi linear, uma vez que a doente apresentava um padrão tipo 1 espontâneo e um episódio de síncope.
A implantação de CDI tem uma indicação classe I em indivíduos com padrão de Brugada tipo 1 e episódio prévio de morte súbita abortada ou síncope, uma vez que estes doentes têm um comprovado alto risco de recorrência de arritmias ventriculares (17‐62% aos 48‐84 meses de seguimento)21–23.
A abordagem do doente assintomático é o tema mais controverso na estratificação de risco na SBr24. A incidência de eventos disrítmicos malignos nestes indivíduos varia de acordo com as séries entre 0,24‐1,7%/ano25. Assim, torna‐se pertinente identificar variáveis de risco, que permitam identificar os indivíduos que beneficiam de implantação de CDI para prevenção primária.
A presença de um padrão de Brugada tipo 1 espontâneo, independentemente da localização das derivações V1 a V312, e o sexo masculino associam‐se a um prognóstico adverso26.
A estimulação elétrica programada (EEP) para a indução de arritmias ventriculares é o método de estratificação que maior controvérsia tem gerado. Segundo vários estudos publicados por Brugada et al. a indução de disritmias com a EEP é um preditor independente de eventos disrítmicos malignos26. Já Giusetto et al. demonstraram o seu elevado valor preditivo negativo27. Contudo, estes resultados não são consistentes e noutros estudos não foi possível comprovar a associação entre um resultado positivo na EEP e a incidência de eventos disrítmicos22,23,28,29, nem o seu valor preditivo negativo29. Uma das explicações possíveis para a divergência de resultados é a utilização de protocolos de estimulação diferentes24.
Outros marcadores têm sido propostos para a estratificação de risco como a fragmentação do QRS29, um período refratário ventricular <200ms29 ou uma elevação de ST durante a fase de recuperação do exercício30. A fibrilhação auricular, encontrada em 10‐54% dos doentes com SBr, foi também associada a um pior prognóstico31.
Em contrapartida, nenhuma das mutações conhecidas no gene SCN5A se associa a pior prognóstico, bem como a história familiar de morte súbita7,11.
Apesar de os avanços realizados na caracterização da SBr nas últimas décadas, a implantação de CDI é a única terapia eficaz na prevenção de morte súbita, sendo a sua implantação nos indivíduos sintomáticos consensual2.
Em países onde o custo da implantação de CDI é proibitivo, em crianças, em doentes com múltiplos choques apropriados de CDI e em casos de tempestade arrítmica a terapêutica farmacológica pode ter um papel importante24. Esta visa o reequilíbrio das correntes iónicas através do bloqueio dos canais Ito (quinidina e tedisamil), da ativação dos canais de cálcio tipo L (isoprenalina) ou de ambos (inibidores da fosfodiesterase III – cilostazol)2. A utilização destes agentes tem‐se mostrado eficaz na normalização da elevação do segmento ST e no controlo de tempestades arrítmicas, especialmente em crianças32.
O estudo da família após identificação de um caso índex é fundamental, atendendo ao padrão de transmissão autossómico dominante.
A utilidade do estudo genético é relativa, uma vez que em apenas 18‐30% dos casos é identificada uma mutação patogénica no gene SCN5A, e mesmo nestes a penetrância é no máximo de 16%5,9. Contudo, nos casos em que a mutação é conhecida, é possível identificar os indivíduos portadores e, como tal, que estarão em risco de desenvolver a doença25.
Ambos os filhos da doente são assintomáticos e apresentam um ECG normal, independentemente da localização das derivações V1 a V3, tendo indicação para realizar um teste de provocação, segundo alguns autores6. Contudo, um resultado negativo não exclui o diagnóstico16, pelo que é importante o seguimento destes indivíduos com a realização regular de ECG, nomeadamente em contexto febril. A realização de ECG a todos os doentes com antecedentes de síncope durante um episódio de febre parece ser atrativa ao aumentar a sensibilidade diagnóstica. A febre tem sido também reconhecida como um fator precipitante de eventos disrítmicos em doentes com SBr13.
O tratamento imediato da febre é essencial, devendo ter‐se também em atenção os fármacos a evitar pelo risco de indução de arritmias. Aconselha‐se a consulta da lista de medicamentos (www.brugadadrugs.org) sempre que se inicia um fármaco em doentes com SBr33. No caso da nossa doente, a escolha do antipirético e da antibioterapia foi feita com segurança, visto que não estão reportados eventos disrítmicos associados ao uso do paracetamol, nem de antibióticos.
ConclusõesA SBr caracteriza‐se pela sua dificuldade diagnóstica e de estratificação de risco, sendo o caso desta doente paradigmático. O carácter intermitente do padrão eletrocardiográfico tipo 1 pode adiar no tempo o diagnóstico. Assim, torna‐se pertinente, na opinião dos autores, a ponderação da realização de eletrocardiograma em contexto febril, a todos os doentes com antecedentes de síncope, numa relação que poderá ser eventualmente custo‐eficaz.
FinanciamentoO coautor Rui Providência usufrui de uma bolsa de pesquisa da Medtronic® e de uma bolsa de formação em eletrofisiologia concedida pela Boston Scientific® e Sorin®.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesO coautor Rui Providência usufrui de uma bolsa de pesquisa da Medtronic® e de uma bolsa de formação em eletrofisiologia concedida pela Boston Scientific® e Sorin®. Os restantes autores declaram não ter conflitos de interesses.