O tromboembolismo venoso, cujo risco está aumentado no doente cirúrgico, é uma causa evitável de morbimortalidade. O objetivo primário deste estudo foi estimar o risco de tromboembolismo venoso sintomático pós‐operatório global e por especialidade cirúrgica, num hospital terciário. Secundariamente, foram analisadas a gravidade e mortalidade dos eventos tromboembólicos.
MétodosFoi realizado um estudo retrospetivo para a identificação de casos de tromboembolismo venoso pós‐operatório intra‐hospitalar, codificados pela Classificação Internacional de Doenças – 9.ª revisão, pelos critérios da Joint Commission International. Foram incluídos episódios de internamento de doentes adultos, operados, no período 2008‐2012.
ResultadosEm 67635 episódios de internamento com cirurgia identificaram‐se 90 casos de tromboembolismo venoso pós‐operatório (mediana de idades: 59 anos), correspondendo a um risco de 1,33/1000 episódios (intervalo de confiança a 95% [IC95%], 1,1‐1,6/1000). A neurocirurgia apresentou maior risco (4,07/1000), seguida pela urologia e pela cirurgia geral p<0,001. Houve 50 episódios de embolia pulmonar, dos quais 11 foram fatais. Dos 90 casos, 12,2% decorreram sob anestesia do neuro‐eixo e 55,1% em doentes em estado físico ASA III. Foi administrada dose profilática de anticoagulante injetável no pós‐operatório a, pelo menos, 37,7% dos doentes. O risco decresceu de 2008 até 2012. A mortalidade associada aos eventos de tromboembolismo venoso durante o internamento foi 21,1% (IC95%, 13,6‐30,4).
ConclusõesO risco de tromboembolismo venoso sintomático pós‐operatório foi de 1,33/1000. A neurocirurgia apresentou maior risco. A mortalidade foi de 21,1%.
Venous thromboembolism, risk of which is increased in surgical patients, is a preventable cause of morbidity and death. The primary objective of this study was to estimate the incidence of symptomatic postoperative venous thromboembolism in adults at a tertiary university hospital, overall and by surgical specialty. The secondary objective was to analyze severity of and mortality from thromboembolic events.
MethodsWe performed a retrospective study to identify cases of in‐hospital postoperative venous thromboembolism, encoded by the International Classification of Diseases, Ninth Revision, according to the Joint Commission International criteria. Adult patients admitted for surgery in 2008‐2012 were included.
ResultsAmong 67 635 hospitalizations, 90 cases of postoperative symptomatic venous thromboembolism were identified, corresponding to an incidence of 1.33/1000 admissions (95% confidence interval [CI] 1.1‐1.6/1000). Neurosurgery had the highest risk (4.07/1000), followed by urological surgery and general surgery (p<0.001). There were 50 cases of pulmonary embolism, 11 of which were fatal. Of the 90 cases, 12.2% occurred under neuraxial anesthesia and 55.1% in patients with American Society of Anesthesiology III physical status. At least 37.7% of patients with events received a prophylactic dose of injectable anticoagulant postoperatively. The overall risk decreased from 2008 to 2012. Venous thromboembolism‐associated mortality during hospitalization was 21.1% (95% CI 13.6‐30.4).
ConclusionsThe incidence of postoperative symptomatic venous thromboembolism was 1.33/1000. Neurosurgery showed the greatest risk. Mortality was 21.1%.
Classificação Internacional de Doenças – 9.a revisão – Modificação Clínica
embolia pulmonar
intervalo de confiança a 95%
percentil 25
percentil 75
probabilidade calculada
tromboembolismo venoso
TRomboEmbolismo Venoso pós‐Operatório
trombose venosa profunda
O tromboembolismo venoso (TEV), que inclui a trombose venosa profunda (TVP) e a embolia pulmonar (EP), é uma importante causa de morbimortalidade e acarreta custos financeiros elevados, sendo considerado um grave problema de saúde pública. As estimativas de incidência de TEV variam entre 104‐183/100000 pessoas/ano1; a mortalidade precoce é de cerca de 12,6% e a mortalidade aos cinco anos é de 50‐60% para a EP e de 25% para a TVP2.
É difícil obter estimativas válidas e comparáveis da incidência de TEV por vários motivos. A sintomatologia e os sinais clínicos não são específicos, levando ao diagnóstico de apenas cerca de 50% dos casos, e o valor preditivo dos testes de rastreio em doentes assintomáticos é baixo3. Estes fatores contribuem para a variação de dados epidemiológicos encontrada em diferentes estudos, apesar de haver também diferenças étnicas1.
No doente cirúrgico o risco de TEV está aumentado e, na ausência de tromboprofilaxia, varia entre 15‐60%, dependendo do tipo de cirurgia, sendo mais elevado em cirurgia ortopédica major4,5. Para esse risco contribuem, também, fatores específicos do doente, tipo de anestesia e duração do procedimento e do internamento4,5.
O estudo ENDORSE6, que analisou o risco de TEV em 32 países, revelou que, em Portugal, dos 762 doentes cirúrgicos avaliados, 69% estavam expostos a risco aumentado. Apesar da importância do conhecimento de indicadores de resultado, há poucos estudos epidemiológicos sobre TEV no período pós‐operatório em Portugal.
ObjetivosO estudo TRomboEmbolismo Venoso pós‐Operatório (TREVO) teve como objetivo primário estimar o risco de TEV pós‐operatório sintomático, global e por especialidade cirúrgica num hospital terciário. Secundariamente, foi analisada a gravidade e mortalidade dos casos de tromboembolismo, incluindo características dos doentes envolvidos e do tratamento a que foram submetidos.
MétodosO TREVO é um estudo epidemiológico retrospetivo, na população adulta de doentes cirúrgicos do Centro Hospitalar de São João, que é um hospital terciário e universitário. O estudo foi aprovado pela Comissão de Ética para a Saúde da instituição.
Desenho do estudoForam estudados os episódios de internamento de doentes com idade igual ou superior a 18 anos, submetidos a pelo menos uma intervenção cirúrgica, programada ou urgente, no período de um de janeiro de 2008 a 31 de dezembro de 2012, registados em base de dados administrativa.
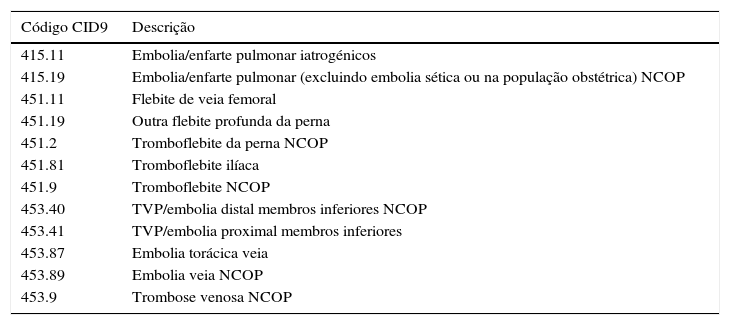
Identificámos casos de TEV, a partir dos códigos da Classificação Internacional de Doenças – 9.ª revisão – Modificação Clínica (CID9) nos diagnósticos secundários, restritos aos primeiros 120 dias de internamento. O critério de TEV utilizado foi o da Joint Commission International7 (Tabela 1).
Critérios da Joint Commission International para definição de tromboembolismo venoso
| Código CID9 | Descrição |
|---|---|
| 415.11 | Embolia/enfarte pulmonar iatrogénicos |
| 415.19 | Embolia/enfarte pulmonar (excluindo embolia sética ou na população obstétrica) NCOP |
| 451.11 | Flebite de veia femoral |
| 451.19 | Outra flebite profunda da perna |
| 451.2 | Tromboflebite da perna NCOP |
| 451.81 | Tromboflebite ilíaca |
| 451.9 | Tromboflebite NCOP |
| 453.40 | TVP/embolia distal membros inferiores NCOP |
| 453.41 | TVP/embolia proximal membros inferiores |
| 453.87 | Embolia torácica veia |
| 453.89 | Embolia veia NCOP |
| 453.9 | Trombose venosa NCOP |
CID9: Classificação Internacional de Doenças, 9.a revisão; NCOP: não compreendido em outra parte; TVP: trombose venosa profunda
Os processos clínicos dos casos identificados foram revistos na edição eletrónica e no arquivo em papel. A informação foi recolhida para um formulário elaborado para o efeito, e incluiu características demográficas e patologia associada dos doentes envolvidos, diagnósticos de admissão e de alta; características do tratamento, nomeadamente, tipo de anestesia, tipo de cirurgia, procedimento de cateterização venosa central, ocorrência de imobilidade pós‐operatória superior a dois dias, prescrição de tromboprofilaxia pós‐operatória; e estado vital à saída do internamento. A variável gravidade dos eventos de TEV pós‐operatório foi analisada em quatro grupos: EP fatal, EP não fatal, TVP e outros TEV.
Foram excluídos os casos de doentes cirúrgicos internados não operados, aqueles com registo incompleto de dados e os casos com diagnóstico secundário de TEV não confirmado. Adicionalmente, excluíram‐se os casos de TEV ocorridos antes da cirurgia.
A seleção dos casos fundamentou‐se no registo objetivo do diagnóstico de TEV no processo clínico, suportado pela descrição de achados imagiológicos. A EP foi confirmada por tomografia computadorizada helicoidal, angiografia de subtração digital ou cintilografia de ventilação/perfusão de alta probabilidade; a TVP por ultrassonografia ou venografia; e outros TEV por ultrassonografia, venografia ou angiorressonância magnética. As imagens não foram visualizadas pelos investigadores, tendo estes validado as informações registadas para comparação com a codificação CID9.
Os episódios inicialmente identificados foram revistos por um investigador diferente para confirmação da informação recolhida.
O outcome considerado foi o TEV sintomático por ser prática instituicional orientar a imagiologia pela clínica, não se fazendo rastreio do TEV.
Nos casos que cursaram com mais do que um evento de TEV, foi considerado apenas o mais grave para efeitos estatísticos.
Análise estatísticaForam elaboradas estatísticas descritivas dos dados, recorrendo à mediana e intervalo interquartis (P25‐P75) para as variáveis quantitativas, e proporções para as variáveis qualitativas. As estimativas são apresentadas com intervalos de confiança a 95% (IC95%). O risco de TEV e de EP entre subgrupos foi comparado pelo teste do quiquadrado. Para avaliar a evolução temporal do indicador de resultado TEV, foi utilizado um teste para a tendência linear. Os dados foram analisados no programa Stata versão 11.1 para Windows (StataCorp LP, College Station, TX) e o Microsoft Excel 2010 (Microsoft Corp, Redmond, WA)
ResultadosSeleção de casosA população estudada no TREVO incluiu 67635 episódios de internamento, em que doentes adultos foram operados pelas especialidades de cirurgia cardiotorácica, geral, plástica, vascular, neurocirurgia, ortopedia, otorrinolaringologia e urologia.
Dos 178 casos inicialmente identificados como TEV, de acordo com os diagnósticos codificados pela CID9, foram excluídos 35 casos de doentes cirúrgicos internados não operados; 16 casos por registo de dados incompleto, nove por codificação incongruente com a informação clínica e 28 por terem ocorrido antes da cirurgia (Figura 1).
Características demográficasO risco global de TEV foi semelhante em doentes do sexo masculino ou feminino (1,35 versus 1,31/1000 episódios, respetivamente, p=0,96). No entanto, nos doentes com EP fatal o rácio feminino/masculino foi de 63,6%.
A mediana de idades dos doentes com TEV foi de 59 anos (P25‐P75: 46‐70). A diferença da média das idades dos casos de TEV não foi significativa comparativamente à de toda a população estudada (p=0,191). Os casos de EP fatal ocorreram na média das idades 63,3±10,6. Os doentes com TVP pertenceram a um escalão etário tendencialmente mais baixo (média 54±16,3).
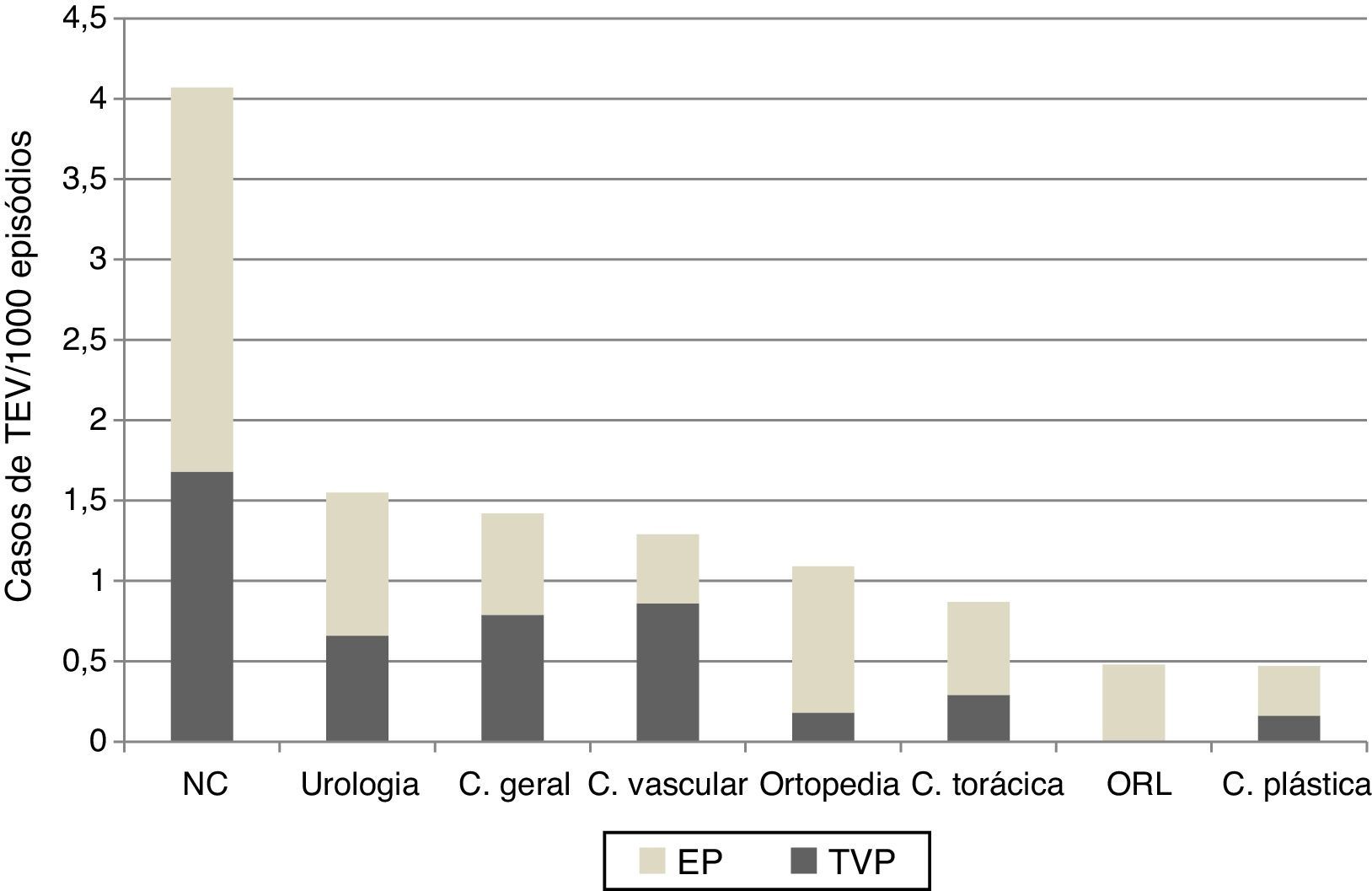
Risco por especialidade cirúrgicaAos 90 casos de TEV sintomático pós‐operatório confirmados correspondeu um risco de 1,33/1000 episódios (IC95%, 1,1‐1,6/1000). No que respeita ao risco estimado por especialidade cirúrgica, a neurocirurgia foi a especialidade com maior risco (4,07/1000), seguida da urologia (1,55/1000) e cirurgia geral (1,42/1000), p<0,001. A especialidade com menor risco foi a cirurgia plástica (0,47/1000) (Figura 2).
Risco de tromboembolismo venoso (TEV) com ou sem embolia pulmonar (EP), por especialidade cirúrgica. C. geral: cirurgia geral; C. plástica: cirurgia plástica, reconstrutiva e maxilofacial; C. torácica: cirurgia torácica; C. vascular: cirurgia vascular; NC: neurocirurgia; OTL: otorrinolaringologia.
Nos casos neurocirúrgicos, foi observada EP em cinco casos de cirurgia de remoção de lesões neoplásicas (dois neurinomas do acústico, astrocitoma, adenoma da hipófise e meningioma) e em outros cinco casos cirúrgicos diversos (duas drenagens de abcesso cerebral, biopsia cerebral, drenagem de hemorragia cerebral, colocação de um monitor de pressão intracraniana). Ocorreram TVP em três cirurgias de drenagem de hematoma subdural e numa drenagem de hemorragia intracerebral. Um doente de Parkinson submetido a implantação de neuroestimulador intracraniano teve outro tipo de TEV. Nenhum dos casos com lesões neoplásicas apresentou EP fatal.
Dos 14 doentes urológicos, quatro foram submetidos a transplante renal e em três destes ocorreu EP (um outro TEV). Um dos transplantados apresentou EP, TVP e outro TEV. Este e outro transplantado, ambos homens, faleceram. A EP complicou ainda uma resseção transuretral da próstata, uma ureteroscopia com biopsia e uma nefroureterectomia. Os restantes episódios urológicos foram TVP.
Dos 90 casos de TEV identificados, 11 (12,2%) decorreram sob anestesia do neuroeixo, das quais três combinadas com anestesia geral e duas combinadas do neuroeixo (bloqueio subaracnoideu e epidural).
Os casos de TEV distribuíram‐se por estado físico da American Society of Anesthesiology (ASA), segundo o descrito: ASA III (55,1%), ASA II (21,4%) e ASA IV (13,5%).
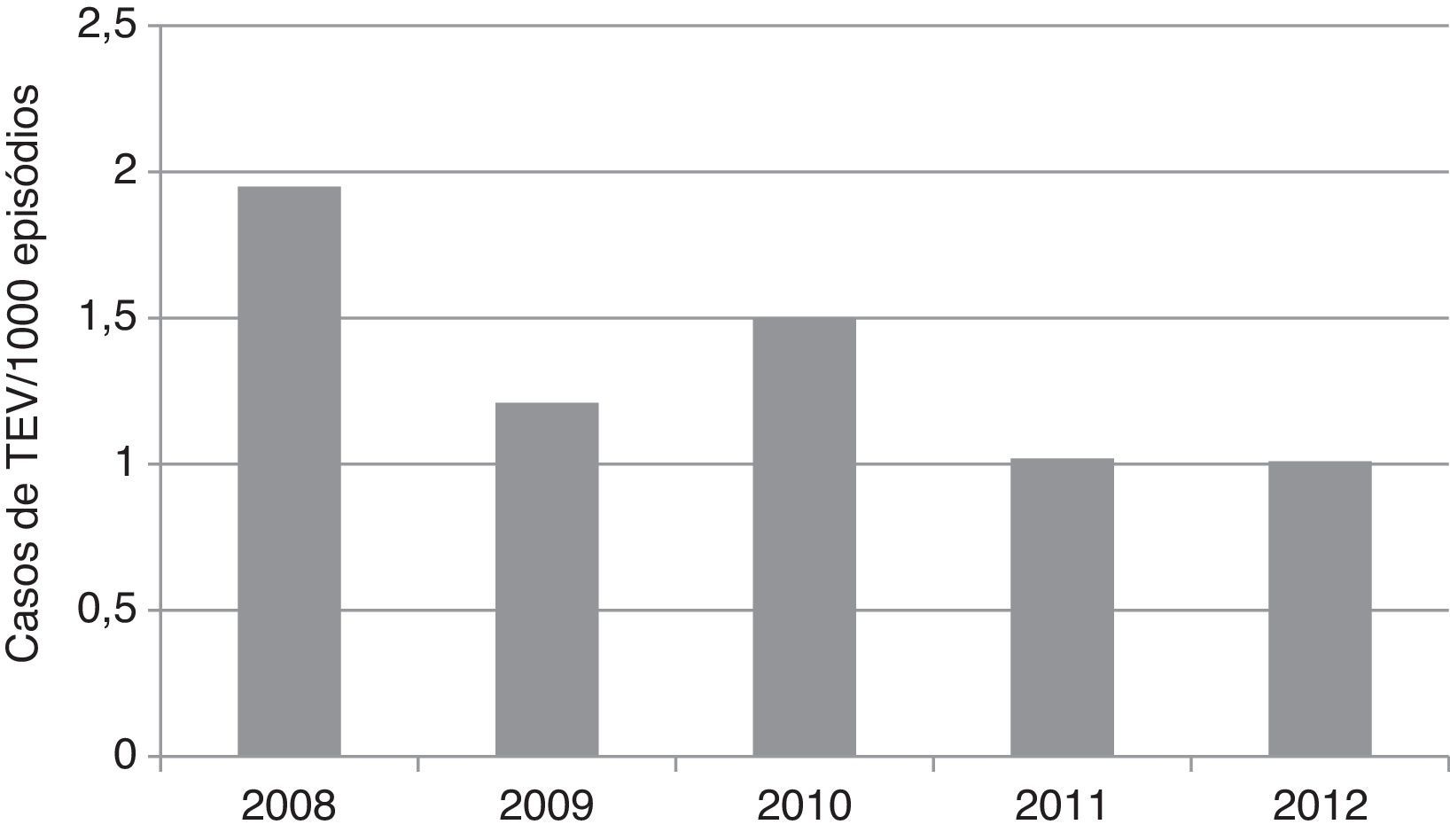
O risco global decresceu ao longo dos anos no período de estudo, de 1,95/1000 em 2008 até 1,01/1000 em 2012 (ptendência linear=0,036) (Figura 3).
Gravidade dos eventosNo total dos casos, identificaram‐se 50 casos de EP, correspondendo a um risco de 0,75/1000 episódios (IC95% 0,56‐0,99/1000), mais elevado na neurocirurgia (2,39/1000), seguida da ortopedia (0,91/1000) e urologia (0,89/1000) (Figura 2).
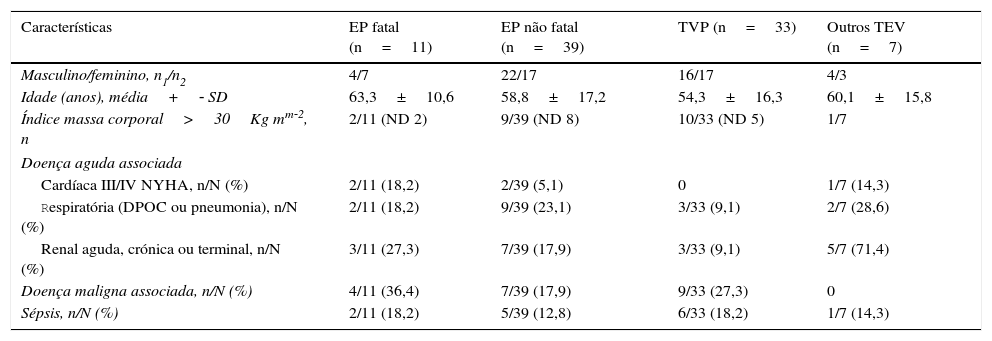
Houve 11 EP fatais (mortalidade 22,0%), a que esteve associada uma maior percentagem de doentes com doença maligna ou com insuficiência renal (Tabela 2). Mais de metade destes doentes tinham sido submetidos a cateterização venosa central na subclávia direita e, se incluída a cateterização da jugular interna, 72,7% dos doentes tinham cateter central (Tabela 3).
Características dos doentes por tipo de evento tromboembólico
| Características | EP fatal (n=11) | EP não fatal (n=39) | TVP (n=33) | Outros TEV (n=7) |
|---|---|---|---|---|
| Masculino/feminino, n1/n2 | 4/7 | 22/17 | 16/17 | 4/3 |
| Idade (anos), média+‐ SD | 63,3±10,6 | 58,8±17,2 | 54,3±16,3 | 60,1±15,8 |
| Índice massa corporal>30Kg mm‐2, n | 2/11 (ND 2) | 9/39 (ND 8) | 10/33 (ND 5) | 1/7 |
| Doença aguda associada | ||||
| Cardíaca III/IV NYHA, n/N (%) | 2/11 (18,2) | 2/39 (5,1) | 0 | 1/7 (14,3) |
| Respiratória (DPOC ou pneumonia), n/N (%) | 2/11 (18,2) | 9/39 (23,1) | 3/33 (9,1) | 2/7 (28,6) |
| Renal aguda, crónica ou terminal, n/N (%) | 3/11 (27,3) | 7/39 (17,9) | 3/33 (9,1) | 5/7 (71,4) |
| Doença maligna associada, n/N (%) | 4/11 (36,4) | 7/39 (17,9) | 9/33 (27,3) | 0 |
| Sépsis, n/N (%) | 2/11 (18,2) | 5/39 (12,8) | 6/33 (18,2) | 1/7 (14,3) |
DPOC: doença pulmonar obstrutiva crónica; EP: embolia pulmonar; I: insuficiência; n: número de casos por característica; N: número total de casos de eventos; ND: casos sem informação disponível; NYHA: New York Heart Association; TEV: tromboembolismo venoso; TVP: trombose venosa profunda; SD: desvio padrão.
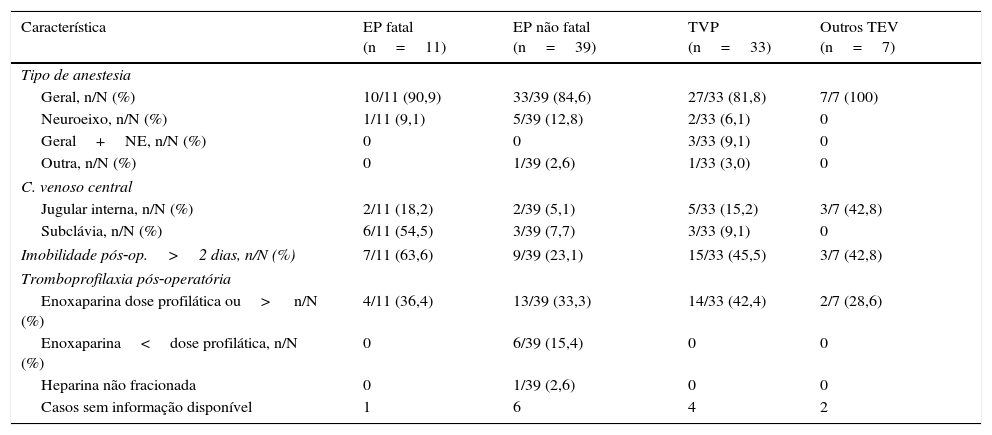
Características do tratamento por tipo de evento tromboembólico
| Característica | EP fatal (n=11) | EP não fatal (n=39) | TVP (n=33) | Outros TEV (n=7) |
|---|---|---|---|---|
| Tipo de anestesia | ||||
| Geral, n/N (%) | 10/11 (90,9) | 33/39 (84,6) | 27/33 (81,8) | 7/7 (100) |
| Neuroeixo, n/N (%) | 1/11 (9,1) | 5/39 (12,8) | 2/33 (6,1) | 0 |
| Geral+NE, n/N (%) | 0 | 0 | 3/33 (9,1) | 0 |
| Outra, n/N (%) | 0 | 1/39 (2,6) | 1/33 (3,0) | 0 |
| C. venoso central | ||||
| Jugular interna, n/N (%) | 2/11 (18,2) | 2/39 (5,1) | 5/33 (15,2) | 3/7 (42,8) |
| Subclávia, n/N (%) | 6/11 (54,5) | 3/39 (7,7) | 3/33 (9,1) | 0 |
| Imobilidade pós‐op.>2 dias, n/N (%) | 7/11 (63,6) | 9/39 (23,1) | 15/33 (45,5) | 3/7 (42,8) |
| Tromboprofilaxia pós‐operatória | ||||
| Enoxaparina dose profilática ou> n/N (%) | 4/11 (36,4) | 13/39 (33,3) | 14/33 (42,4) | 2/7 (28,6) |
| Enoxaparina<dose profilática, n/N (%) | 0 | 6/39 (15,4) | 0 | 0 |
| Heparina não fracionada | 0 | 1/39 (2,6) | 0 | 0 |
| Casos sem informação disponível | 1 | 6 | 4 | 2 |
C: cateter; EP: embolia pulmonar; NE: neuroeixo; TEV: tromboembolismo venoso; TVP: trombose venosa profunda.
A imobilidade superior a dois dias esteve associada a um maior número de eventos graves (Tabela 3).
Pelo menos 37,7% dos doentes com eventos estavam sob dose profilática de anticoagulante injetável no pós‐operatório (Tabela 3).
Houve 19 doentes com TEV que faleceram e as possíveis causas associadas estão explicitadas na Tabela 4.
Causas associadas à mortalidade dos eventos de tromboembolismo venoso
| Causas | Número casos |
|---|---|
| Choque cardiogénico | 1 |
| Choque séptico | 1 |
| Embolia pulmonar | 11 |
| Infeção renal | 1 |
| Insuficiência renal | 1 |
| Neoplasia maligna do rim | 1 |
| Pneumonia | 1 |
| Sépsis+FMO | 1 |
| Trombose venosa profunda+síndrome veia cava inferior | 1 |
FMO: falência multiorgânica.
A mortalidade do total dos episódios de TEV foi de 21,1% (IC95%, 13,6‐30,4).
DiscussãoNo TREVO englobaram‐se doentes de cirurgia programada e urgente de oito especialidades. Estimou‐se um risco de TEV de 1,33/1000 episódios, correspondente ao outcome intra‐hospitalar. Comparativamente ao risco atribuído à população cirúrgica portuguesa no estudo ENDORSE (69%), este valor é extremamente baixo. O ENDORSE considera não o outcome, mas a avaliação dos fatores de risco e somente em doentes agudos, de cirurgia geral, uroginecologia e ortotraumatologia6,10, constituindo estes um grupo de maior risco de TEV. Bilimoria et al. relatam um risco de 5,35/1000 num estudo multicêntrico, fundamentado em outcomes, que inclui ortopedia, neurocirurgia, cirurgia cardiotorácica, urologia e cirurgia geral8. Neste estudo, baseado na população norte‐americana, os autores chamam a atenção para o facto de o nível de vigilância clínica constituir um importante viés nos resultados encontrados, tanto maior quanto mais interventivos sejam os protocolos locais no pedido de exames imagiológicos. Se, por um lado, alguns eventos têm sintomatologia fruste, podendo não ser valorizados em locais em que a imagiologia (standard diagnóstico) é orientada pela clínica, por outro, em alguns centros, como nos de traumatologia, a imagiologia é feita por rotina8.
O risco de TEV observado neste estudo incorpora o efeito da tromboprofilaxia, que reduz a incidência de TEV de 50‐75%9, refletindo os processos institucionais. Além disso, o TEV sintomático, que foi o outcome considerado, representa cerca de 50% de todos os eventos de TEV3. Ainda assim, o TREVO mostra valores mais baixos do que outros encontrados na literatura, o que pode, por um lado, relacionar‐se com rejeição de casos por inconformidade no processo clínico ou menor sensibilidade no diagnóstico/registo. Neste último caso, poderá justificar‐se a elevada mortalidade por os eventos fatais obrigarem a um registo mais conforme, tanto mais que a literatura descreve uma incidência de EP inferior a outros TEV, o que não foi constatado neste estudo, levantando a hipótese de subdiagnóstico de outros TEV, que não EP, proporcionalmente. Por outro lado, este menor risco pode refletir tromboprofilaxia mais adequada.
No TREVO, a especialidade com maior risco de TEV foi a neurocirurgia. A especialidade descrita na literatura como exposta a maior risco4,10,12,13 é a ortopedia. Tzu‐Frei Wang et al., num estudo retrospetivo de 94 casos de TEV intra‐hospitalar, identificaram a cirurgia intracraniana como fator preditivo de TEV, com um odds ratio singularmente elevado de 16,19. Num estudo anterior, Hamilton et al. observaram que metade dos doentes neurocirúrgicos, quando triados imagiologicamente, apresentavam TEV detetável, enquanto só 5% desenvolviam TEV sintomático14. Um fator de risco conhecido de TEV que pode estar associado é o facto da cirurgia intracraniana envolver cateterização venosa central numa elevada percentagem de casos. Um estudo retrospetivo associou a cateterização venosa central à duplicação do risco de TEV intra‐hospitalar15. Além disso, muitos destes doentes são internados em unidades de cuidados intensivos e têm tempos operatórios e internamentos mais prolongados, fatores adicionais de risco de TEV. A limitação ao uso de tromboprofilaxia farmacológica, inerente à especialidade de neurocirurgia, mais do que a população tratada, está também de acordo com o aumento de risco constatado. Este facto reforça a necessidade, já contemplada em algumas guidelines4,5, de fazer tromboprofilaxia mecânica desde o pré‐operatório no doente neurocirúrgico e de ponderar profilaxia medicamentosa em doentes de maior risco de TEV.
O TREVO estima o risco de TEV intra‐hospitalar. Embora seja conhecido o elevado risco de TEV em cirurgia ortopédica major, as taxas de eventos sintomáticos pós‐operatórios até à alta não traduzem o risco global, porque no caso da artroplastia da anca o tempo médio de eventos sintomáticos é ao 17.° dia e no caso da artroplastia do joelho é ao 7.° dia, estendendo‐se o período de elevado risco por 12 semanas no primeiro caso e seis no segundo11,3. Estes doentes, com os cada vez mais frequentes programas de enhanced recovery, têm alta muito antes dos tempos referidos, enviesando ainda mais o registo intra‐hospitalar de eventos como medida de risco, o que pode justificar o aparecimento da ortopedia em 5.° lugar (1,09/1000 episódios) no TREVO.
O risco associado à urologia (1,55/1000) surge em segundo lugar no TREVO. Embora seja um grupo de risco menos documentado, um estudo de coorte recente relata uma taxa de TEV moderada/alta para cistectomia total (3,96%) e parcial (2,35%), seguindo‐se a nefrectomia aberta radical (1,67%)16. Outros estudos documentam um elevado risco de TEV associado à transplantação renal (7,9‐9,1%)17,18. A população de doentes estudados no TREVO inclui uma unidade de transplantação renal, o que contribuiu para a proporção de valores encontrada. Beyer et al. referem uma incidência elevada de EP (5,8%) na prostatectomia19, outro procedimento comum na população estudada.
A tendência decrescente na evolução anual do risco global de TEV, de 2008‐2012, é favorável à hipótese de uma tromboprofilaxia progressivamente mais adequada.
A mortalidade encontrada no total dos eventos de TEV (21,1%) foi mais alta do que a descrita na literatura e próxima da mortalidade por EP (22,0%), sendo esta também elevada. Reis refere uma mortalidade precoce por TEV de 12,6%2. Dados do Nation wide Inpatient Sample indicam uma mortalidade intra‐hospitalar por EP de 12,3‐8,2%, com tendência decrescente ao longo dos anos20. Num estudo norueguês, a mortalidade aos 30 dias por EP foi de 9,7% e a de TVP de 4,6%21. A mortalidade encontrada no TREVO em comparação com estes valores reforça a hipótese de subdiagnóstico de eventos não fatais.
A anestesia do neuroeixo, neste estudo, foi realizada em 12,2% das cirurgias. Numa meta‐análise, Rodgers et al. mostraram que a anestesia epidural modifica radicalmente o risco de TEV, com reduções de 44 e 55% para a TVP e EP, respetivamente22. Outra meta‐análise confirmou o benefício da anestesia epidural lombar contínua no período pós‐operatório na redução do risco de TEV em cirurgia dos membros inferiores e prostatectomia23. Este facto pode contribuir para a explicação da redução de risco encontrada em ortopedia, onde a anestesia do neuroeixo é a técnica mais utilizada na cirurgia major dos membros inferiores.
Em relação ao estado físico ASA, neste estudo o estado ASA III (55,1%) foi o predominante. Está descrito, na literatura, um agravamento do risco de TEV com o progressivo aumento do ASA para cirurgia da anca24.
Este estudo tem várias limitações. A primeira é o facto de ser retrospetivo e, portanto, observacional e dependente da informação disponível no processo clínico. A segunda é a exclusão de casos por inconformidades no registo clínico. A terceira é o hipotético viés de vigilância de eventos entre serviços, o que, a par da segunda, pode contribuir para subdiagnóstico. A quarta é considerar apenas eventos intra‐hospitalares, desvalorizando os que ocorrem após alta. A quinta é não dispor na totalidade dos casos, de dados sobre a administração da profilaxia tromboembólica e, nomeadamente, da avaliação do risco de TEV pré‐operatório (e da indicação à luz da evidência atual) dos doentes em causa, para avaliar com maior precisão o impacto da tromboprofilaxia.
Dos aspetos positivos do TREVO, há a salientar: não se conhecerem estudos publicados sobre TEV pós‐operatório em Portugal, além do ENDORSE, sobretudo com amostras semelhantes; incluir uma amostra de 67635 doentes, com 90 casos documentados de TEV, o que compara com outros estudos internacionais; tratar‐se de um estudo feito com base em outcomes e não na avaliação do risco; acautelar alguns viéses de seleção, nomeadamente tendo em conta os códigos da CID e os critérios de TEV definidos pela Joint Commission International.
ConclusãoNeste estudo, o risco de TEV sintomático pós‐operatório foi de 1,33/1000 episódios. A especialidade com maior risco de TEV e de EP foi a neurocirurgia.
A mortalidade foi de 21,1%. Não é de excluir subdiagnóstico ou ausência de registo de eventos não fatais.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.


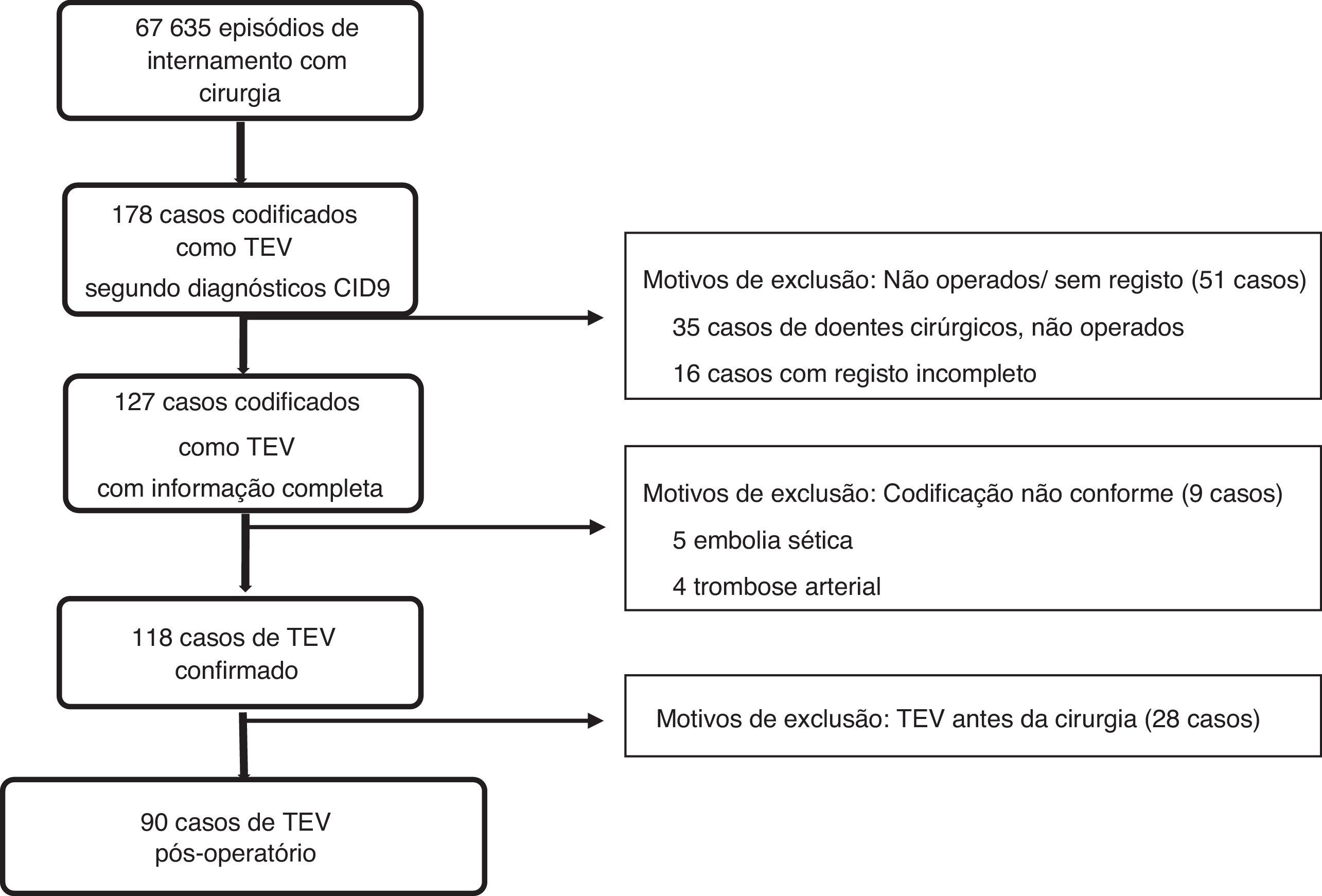

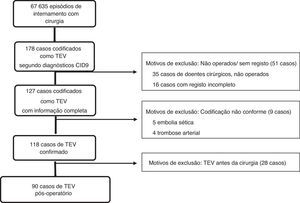 TEV) na população estudada.' title='Identificação de casos de tromboembolismo venoso (
TEV) na população estudada.' title='Identificação de casos de tromboembolismo venoso (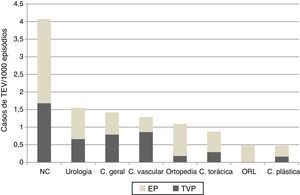 TEV) com ou sem embolia pulmonar (EP), por especialidade cirúrgica. C. geral: cirurgia geral; C. plástica: cirurgia plástica, reconstrutiva e maxilofacial; C. torácica: cirurgia torácica; C. vascular: cirurgia vascular; NC: neurocirurgia; OTL: otorrinolaringologia.' title='Risco de tromboembolismo venoso (
TEV) com ou sem embolia pulmonar (EP), por especialidade cirúrgica. C. geral: cirurgia geral; C. plástica: cirurgia plástica, reconstrutiva e maxilofacial; C. torácica: cirurgia torácica; C. vascular: cirurgia vascular; NC: neurocirurgia; OTL: otorrinolaringologia.' title='Risco de tromboembolismo venoso (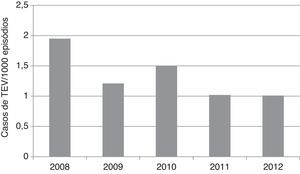 TEV), 2008‐2012.' title='Evolução anual do risco global de tromboembolismo venoso (
TEV), 2008‐2012.' title='Evolução anual do risco global de tromboembolismo venoso (

