O progresso técnico associado aos cuidados de saúde tem permitido uma melhoria da sobrevida e da qualidade de vida dos doentes, não sendo, no entanto, isento de complicações.
Apresenta‐se o caso de uma doente de 74 anos, com história de cardiopatia hipertensiva com função sistólica preservada, fibrilhação auricular e dislipidemia. Era portadora de pacemaker DDDR desde 2005 por bloqueio auriculoventricular completo sintomático.
Referia quadro arrastado de agravamento progressivo de cansaço, astenia, ascite com epigastralgia e edema dos membros inferiores, acompanhado de colestase hepática bioquímica inespecífica. A ecografia abdominal revelou hepatomegalia homogénea e dilatação das veias cava inferior e supra‐hepáticas, sugestivos de hepatite de estase.
Apresentava, ecocardiograficamente, insuficiência tricúspide em agravamento progressivo nos últimos 4 anos, com dilatação e disfunção progressiva do ventrículo direito, mantendo função ventricular esquerda preservada. O ecocardiograma transesofágico revelou regurgitação tricúspide major por flail leaflet do folheto septal, com dilatação marcada do anel valvular, em relação com efeito mecânico do electrocatéter de pacemaker, que se encontrava aderente ao folheto septal. Optou‐se por tratamento cirúrgico minimamente invasivo, com ressecção parcial do folheto, colocação de anel tricúspide e recolocação do electrocatéter de pacing no ventrículo direito.
Observou‐se regressão dos sintomas de congestão, objetivando‐se o anel protésico tricúspide sem evidência de estenose e cavidades direitas apenas ligeiramente dilatadas, com hipertensão pulmonar moderada. Cerca de seis meses após o procedimento, a doente sofreu um evento neurológico agudo, com evolução desfavorável, tendo vindo a falecer.
Technical advances in health care have improved patient survival and quality of life, but are not devoid of complications.
We present the case of a 74‐year‐old woman with a history of hypertensive heart disease with preserved systolic function, atrial fibrillation and dyslipidemia. She had a DDDR pacemaker implanted in 2005 due to symptomatic complete atrioventricular block.
The patient reported progressive fatigue, weakness, ascites with abdominal discomfort, and lower limb edema, accompanied by non‐specific hepatic cholestasis on biochemical testing. Abdominal ultrasound revealed homogeneous hepatomegaly and dilatation of the inferior vena cava and upper hepatic veins, suggestive of congestive hepatopathy.
Echocardiography revealed tricuspid regurgitation progressively worsening over the previous four years and dilatation and progressive dysfunction of the right ventricle, with preserved left ventricular function. The transesophageal echocardiogram revealed severe tricuspid regurgitation with flail septal leaflet and marked dilatation of the tricuspid annulus due to mechanical interference of the pacemaker lead, which was adhering to the septal leaflet. Minimally invasive surgical treatment was performed with partial resection of the leaflet, placement of a tricuspid annuloplasty ring and replacement of the pacemaker lead.
Regression of the congestive symptoms was observed, and the postoperative echocardiogram showed the tricuspid annuloplasty ring with no evidence of stenosis and only slightly dilated right chambers with moderate pulmonary hypertension. Six months after the procedure, the patient suffered an acute neurological event and died.
De entre as valvulopatias, a regurgitação tricúspide tem recebido menor atenção que as lesões das válvulas aórtica e mitral, sendo mesmo referida como a «válvula esquecida» 1.
Segundo o Framingham Heart Study, a prevalência da regurgitação tricúspide moderada ou grave é de cerca de 0,8% e aumenta com a idade, sendo quatro vezes mais frequente em mulheres2. Encontra‐se geralmente associada a patologia valvular mitral e mais de um terço dos pacientes com estenose mitral tem regurgitação tricúspide pelo menos moderada3.
A etiologia da regurgitação tricúspide divide‐se em primária (ou intrínseca) e secundária (ou funcional). A forma primária resulta de alterações estruturais do aparelho valvular, podendo ser congénitas ou adquiridas, e representa apenas 8% a 10% de todos os casos de regurgitação grave4. A forma secundária geralmente deve‐se à dilatação do anel tricúspide causada por dilatação e disfunção ventricular direita, que pode ser primária ou secundária a doenças do coração esquerdo que resultam em hipertensão pulmonar. Na maioria dos doentes a regurgitação tricúspide é funcional, não estando relacionada com patologia valvular primária, e é frequentemente observada em estádios avançados de valvulopatia esquerda ou doença miocárdica. Em 14% dos doentes a regurgitação tricúspide pode ocorrer na ausência de alterações estruturais da válvula, hipertensão pulmonar ou disfunção cardíaca esquerda5.
Alguns fatores, como a fibrilhação auricular, presença de electrocatéteres de pacemaker, hipertensão pulmonar, remodeling e pressão ventricular direita aumentada, e a gravidade da deformação valvular, são de risco para a persistência e o agravamento da regurgitação tricúspide6. Quando esta se torna significativa, o remodeling progressivo do ventrículo direito e a disfunção devida à sobrecarga crónica de volume resultam no deslocamento dos músculos papilares e no afastamento dos folhetos valvulares, o que agrava a regurgitação e, por sua vez, a dilatação ventricular direita. Por outro lado, o ventrículo direito dilatado pode causar compressão sobre o ventrículo esquerdo, levando a um aumento da pressão pulmonar e a um agravamento da regurgitação tricúspide. A presença de flailleaflet, classicamente associada a regurgitação grave, associa‐se a menor sobrevida e maior risco de insuficiência cardíaca7.
A cirurgia valvular tricúspide traduz‐se numa morbilidade e mortalidade superior à maioria dos procedimentos cirúrgicos cardíacos, pelo que a sua decisão e o timing dependem da gravidade da regurgitação, da função ventricular direita, das dimensões do anel tricúspide e das manifestações clínicas, assim como da presença de hipertensão pulmonar ou de fibrilhação auricular8.
Caso clínicoApresentamos o caso de uma doente de 74 anos, com antecedentes pessoais de cardiopatia hipertensiva com função sistólica global preservada, dislipidemia e fibrilhação auricular permanente Hipo coagulada com rivaroxabano, encontrando‐se também medicada com amlodipina e bisoprolol. Era portadora de pacemaker DDDR desde 2005 por bloqueio auriculoventricular completo sintomático, sem intercorrências descritas desde a data da sua colocação, sendo regularmente seguida em consulta de cardiologia. Realizara ecocardiograma transtorácico em 2009, apenas com evidência de doença fibrocalcificante mitral com insuficiência mitral ligeira, sem outros achados relevantes.
Iniciou queixas de cansaço para médios esforços e desconforto epigástrico em 2011, sem dispneia ou ortopneia, verificando‐se analiticamente um quadro de colestase hepática em agravamento, que motivou referenciação para consultas de gastroenterologia e de medicina interna. Aquela foi inicialmente atribuída à toma de bloqueador de canais de cálcio, que a doente suspendeu, sem qualquer melhoria. Em 2012, por depleção da bateria, verificou‐se novo episódio de bloqueio auriculoventricular completo sintomático, tendo substituído o gerador do pacemaker, sem qualquer manipulação dos electrocatéteres previamente implantados. Durante esta intercorrência, realizou novo ecocardiograma demonstrando movimento discinérgico do septo secundário a pacing e insuficiência tricúspide moderada com hipertensão pulmonar ligeira, visualizando‐se o electrocatéter nas cavidades direitas. O holter de 24 horas efetuado em 2013 confirmava função de sensing mantida, com ritmo de pacing predominante (93% do tempo de registo). Clinicamente, a doente manteve agravamento progressivo do quadro de cansaço generalizado e astenia, com aparecimento de ascite, epigastralgia e emagrecimento insidioso, juntamente com edema dos membros inferiores, sem febre ou dispneia, tendo recorrido novamente à consulta em 2015.
Da investigação etiológica até à data salientava‐se, na ecografia abdominal, hepatomegalia homogénea com dilatação das veias cava inferior e supra‐hepáticas, sugestivo de hepatite de estase, enquanto ecocardiograficamente se observara insuficiência tricúspide grave (raio PISA> 12mm), em agravamento comparativamente aos exames seriados realizados nos últimos quatro anos, com dilatação e disfunção do ventrículo direito (TAPSE = 13mm), sem hipertensão pulmonar significativa e mantendo função ventricular esquerda preservada. Por este motivo, repetiu ecocardiograma transtorácico que revelou D‐shaping do ventrículo esquerdo com dilatação marcada do anel valvular tricúspide, e válvula também espessada, sem coaptação dos folhetos por flail leaflet do folheto septal. Este era causado aparentemente pelo efeito tensor do electrocatéter do ventrículo direito, que formava uma ansa sobre o septo interauricolar, condicionando regurgitação tricúspide grave (orifício regurgitante de 15mm com fluxo «incalculável») (Vídeos 1 e 2 ‐ Ecocardiograma transtorácico pré‐operatório em modos bidimensional, Doppler cor e 3D evidenciando interferência mecânica do electrocatéter na válvula tricúspide, com regurgitação grave).
Dado o mau prognóstico da doente, optou‐se por tratamento cirúrgico com abordagem mini‐invasiva por toracotomia direita, confirmando‐se intraoperatoriamente perfuração do folheto septal tricúspide pelo electrocatéter, que foi extraído e recolocado junto da comissura anteroseptal do ventrículo direito, seguido de ressecção parcial do folheto e encerramento do orifício com sutura de polipropileno 4‐0 juntamente com colocação de anel tricúspide Carpentier 32. O procedimento decorreu sem intercorrências. No entanto, no pós‐operatório, por se verificar falha esporádica de captura, com necessidade de subida progressiva do limiar de sensing para valores não aceitáveis, e dado tratar‐se de uma doente totalmente dependente de pacing do ventrículo direito, optou‐se por upgrade do pacemaker DDDR para CRT‐P, com colocação do electrocatéter ventricular esquerdo anteriormente ao seio coronário.
A evolução pós‐operatória foi favorável e a doente evoluiu clinicamente com regressão dos sintomas de congestão e aumento da tolerância para médios e grandes esforços. O follow‐up ecocardiográfico demonstrou o anel protésico tricúspide sem evidência de estenose, não se objetivando o efeito tensor do electrocatéter previamente observado, quantificando‐se a regurgitação tricúspide como ligeira (vena contracta de 5mm), e as cavidades direitas também apenas ligeiramente dilatadas (TAPSE = 16mm), com hipertensão pulmonar moderada (PSAP 40mmHg) (Vídeos 3 e 4 ‐ Ecocardiograma transtorácico pós‐operatório em modos bidimensional e Doppler cor com regurgitação tricúspide ligeira).
A doente manteve seguimento regular em consulta de cardiologia, mantendo‐se clinicamente estável e sem queixas com interferência na qualidade de vida.
No entanto, 6 meses depois do procedimento, desenvolveu um AVC isquémico do território vertebro‐basilar com transformação hemorrágica extensa, tendo evoluído desfavoravelmente e vindo a falecer durante o internamento.
DiscussãoApesar de a regurgitação tricúspide ligeira poder ser detetada em 80 a 90%2 da população saudável submetida a ecocardiograma, e de geralmente ser benigna, a regurgitação hemodinamicamente significativa pode traduzir‐se em sintomas debilitantes e encontra‐se associada a mau prognóstico em diversas doenças cardiovasculares. Deste modo, torna‐se necessário entender a sua fisiopatologia e avaliar a sua gravidade, referenciando os doentes atempadamente, de modo a prevenir deterioração clínica e complicações decorrentes.
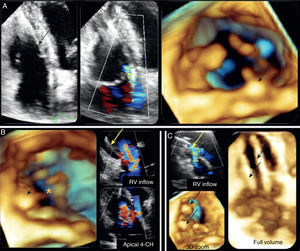
A regurgitação tricúspide devida a implantação de electrocatéter endocárdico ou remoção de pacemaker ou cardiodesfibrilhador implantável é uma complicação conhecida destes procedimentos. Os dados relativos à sua prevalência são incertos e a incidência reportada por alguns estudos é de 7 a 39%9. Os mecanismos envolvidos incluem a interferência mecânica do electrocatéter no encerramento dos folhetos valvulares (por perfuração dos folhetos, aderência à válvula tricúspide ou entanglement com o aparelho subvalvular), assim como a dissincronia ventricular direita induzida pelo pacing, causando disfunção valvular e consequente regurgitação9. Sakai et al. reportaram, num estudo de autópsia de 26 doentes com pacemaker, interferência mecânica nos folhetos valvulares em 42% dos casos10 (Figura 1)11.
A. Vista bidimensional (esquerda) e tridimensional (direita) apical de 4 câmaras demonstrando interferência do eletrocatéter no folheto septal com regurgitação tricúspide; B. Vista tridimensional da perspetiva ventricular direita com não coaptação dos folhetos valvulares e regurgitação grave com electrocatéteres in situ; C. Vista tridimensional da perspetiva ventricular direita evidenciando dois eletrocatéteres através da válvula tricúspide com regurgitação moderada).
O tempo necessário para o desenvolvimento e a progressão da regurgitação tricúspide após a implantação do electrocatéter também não se encontra bem estudado. Estudos patológicos têm detetado alterações inflamatórias cardíacas importantes poucos dias após a implantação12. A progressão da inflamação ao longo de semanas a meses pode levar à formação de tecido fibroso envolvendo o eletrocatéter, resultando numa profunda aderência aos vários componentes do aparelho da válvula tricúspide, e causando regurgitação. A deteção precoce desta complicação é da maior importância, uma vez que a mesma pode ser resolvida pelo reposicionamento do catéter apenas quando realizado precocemente, já que o procedimento pode ser difícil, se não mesmo impossível, num estádio mais avançado.
Segundo a guidelines da Sociedade Europeia de Cardiologia, a correção cirúrgica da regurgitação tricúspide grave encontra‐se indicada em simultâneo com a correção de lesões valvulares esquerdas (classe de evidência I nível C) e deve ser considerada na regurgitação ligeira a moderada em caso de dilatação significativa do anel valvular (> 40mm ou > 21mm/m2) (classe de evidência IIa nível C). A cirurgia limitada à válvula tricúspide deve, no entanto, ser considerada em doentes sintomáticos com regurgitação grave (classe de evidência nível C), sendo que o prognóstico piora quando existe disfunção ventricular direita. A anuloplastia por anel é fundamental neste procedimento. Porém, na presença de electrocatéteres transtricúspide associados a regurgitação, a técnica utilizada deve ser adaptada às condições do doente e à experiência do cirurgião. No caso apresentado, face à presença de regurgitação tricúspide grave com dilatação anular importante e disfunção cardíaca direita severa, impunha‐se cirurgia para extração do electrocatéter e anuloplastia. Por se julgar possível realizar a recolocação daquele no ventrículo direito sob visualização direta com resolução da regurgitação, não se optou por pacing epicárdico, que acarretaria a necessidade de tonalização do mesmo para posição peitoral, com aumento do risco da sua fratura. Dado não se conhecer a possibilidade de cateterização do seio coronário, não foi inicialmente equacionada a possibilidade de pacing esquerdo por este método como primeira alternativa. A presença de hipertensão pulmonar nesta doente, sem patologia valvular esquerda e com boa função sistólica do ventrículo esquerdo, fica por explicar, sendo, no entanto, o seu agravamento provável consequência da realização de duas cirurgias cardíacas consecutivas.
A sobrevida a 10 anos após cirurgia é de 30 a 50%, sendo importantes preditores a classe funcional pré‐operatória, a função ventricular direita e esquerda e a ocorrência de complicações protésicas13. Neste caso, verificou‐se um intervalo de quatro anos desde o aparecimento dos primeiros sintomas até ao diagnóstico, permitindo a progressão da doença e o estabelecimento de dilatação e disfunção ventricular direita, já com sintomatologia constitucional importante. Apesar disto, o resultado pós‐operatório foi satisfatório, tendo a doente recuperado um bom estado funcional e de autonomia.
Em suma, o caso apresentado é ilustrativo da possibilidade de complicações graves e potencialmente irreversíveis associadas a procedimentos considerados rotineiros. A inespecificidade dos sintomas reforça a importância de um elevado grau de suspeita para esta complicação pouco frequente, sendo necessário um seguimento clínico regular e um estudo ecocardiográfico seriado para avaliação do seu impacto.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.