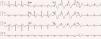É apresentado o caso de uma doente de 60 anos com síndrome de Brugada, padrão tipo 1 permanente, portadora de cardioversor‐desfibrilhador, com episódios frequentes de síncope por taquicardia ventricular polimórfica/fibrilhação ventricular (cerca de cinco por mês), refratários à terapêutica com quinidina e com múltiplos choques apropriados. Foi efetuado mapeamento eletroanatómico endocárdico e epicárdico do ventrículo direito, em ritmo sinusal, confirmando‐se a presença de uma área epicárdica na região anterior da câmara de saída ventricular direita com eletrogramas anómalos, fracionados e de longa duração (até 370 ms), que se prolongavam até 216 ms após o término do QRS de superfície. A ablação epicárdica alargada dessa área, com abolição dos eletrogramas anómalos, conduziu ao desaparecimento do padrão de Brugada na reavaliação eletrocardiográfica efetuada às seis semanas. Apesar da suspensão da terapêutica com quinidina, não ocorreram novas disritmias ventriculares, durante o seguimento, ainda de curta duração.
We present the case of a 60‐year‐old woman with Brugada syndrome, permanent type 1 electrocardiographic pattern, who had previously received an implantable cardioverter‐defibrillator. She suffered frequent syncopal episodes and multiple appropriate shocks (around five per month) due to polymorphic ventricular tachycardia/ventricular fibrillation, refractory to quinidine therapy. Combined epicardial and endocardial electroanatomical mapping was performed with a view to substrate ablation. An area of abnormal fractionated electrograms, lasting up to 370 ms and up to 216 ms after the end of the surface QRS, was identified in the epicardium in the lower anterior part of the right ventricular outflow tract. Extensive epicardial ablation of this area, which eliminated the fractionated electrograms, led to the disappearance of the Brugada electrocardiographic pattern six weeks after ablation. Despite discontinuation of quinidine, no further ventricular arrhythmias occurred during follow‐up, which is still of short duration.
Completaram‐se duas décadas sobre a descrição por Pedro Brugada e Josep Brugada da associação de fibrilhação ventricular primária ao padrão eletrocardiográfico de bloqueio do ramo direito com elevação convexa de ST nas derivações precordiais direitas, em indivíduos sem cardiopatia estrutural1. Desde então, ocorreram notáveis progressos na compreensão dos mecanismos genéticos e fisiopatológicos da síndrome de Brugada, nomeadamente a hipótese da presença de um gradiente elétrico de despolarização entre o endocárdio e o epicárdio como génese das alterações eletrocardiográficas e das disritmias ventriculares associadas2.
A localização topográfica das alterações eletrocardiográficas nas derivações precordiais direitas, em relação com a câmara de saída ventricular direita, cedo suscitou a suspeita de que essa seria a origem dos fenómenos disrítmicos nestes doentes. Porém, as tentativas iniciais de mapeamento endocárdico dessa região cardíaca foram incapazes de elucidar o substrato disrítmico. Foram descritos vários casos em que foi tentada a prevenção da recorrência de fibrilhação ventricular em doentes com síndrome de Brugada e sístoles prematuras ventriculares frequentes, pela ablação endocárdica dessas extrassístoles3–6. Nesses casos, os focos de origem das extrassístoles foram identificados na câmara de saída ventricular direita. No entanto, esta estratégia de ablação apresenta importantes limitações, visto as sístoles prematuras ventriculares não serem usualmente frequentes nestes doentes, tornando‐se por isso dificilmente mapeáveis.
Nademanee et al.7 descreveram recentemente a ablação epicárdica de áreas de despolarização prolongada localizadas na região anterior da câmara de saída ventricular direita em doentes com síndrome de Brugada. Este trabalho constituiu um marco no progresso do conhecimento fisiopatológico da síndrome de Brugada, além de consubstanciar uma nova abordagem terapêutica aparentemente muito eficaz.
Caso clínicoDoente do sexo feminino, de 60 anos de idade, com história de múltiplos episódios sincopais desde há dez anos, sem relação com o esforço ou posição, geralmente precedidos por tonturas e palpitações. Há cinco anos a doente terá tido episódio de paragem respiratória durante o sono, com movimentos tónico‐clónicos generalizados. Há quatro anos o seu filho (39 anos) teve morte súbita, o que suscitou o estudo da família. Foi identificado padrão eletrocardiográfico de Brugada tipo 1 na doente e noutro seu filho, tendo ambos sido submetidos a implantação de cardioversor‐desfibrilhador em maio de 2009.
O estudo por sequenciação direta das regiões codificantes do gene SCN5A não detetou qualquer mutação patogénica. Foram identificados os polimorfismos c.87A > G (p.Ala29Ala) c.3183A > G (p.Glu1061Glu) em homozigotia e c.5457T > C (p.Asp1819Asp) em heterozigotia, os quais correspondem a variantes previamente descritas como não patogénicas.
Desde então, foram documentadas recorrências muito frequentes de taquicardia ventricular polimórfica (coincidindo com os episódios sincopais) e três episódios de choque apropriado por fibrilhação ventricular. A frequência dos eventos disrítmicos aumentou progressivamente, não obstante ter sido medicada com quinidina até à dose máxima tolerada de 400 mg/dia. Nos seis meses precedentes ao procedimento de ablação, a doente teve uma média mensal de cinco episódios de taquicardia ventricular polimórfica/fibrilhação ventricular (entre 4‐8 episódios por mês).
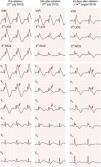
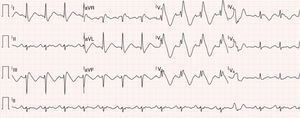
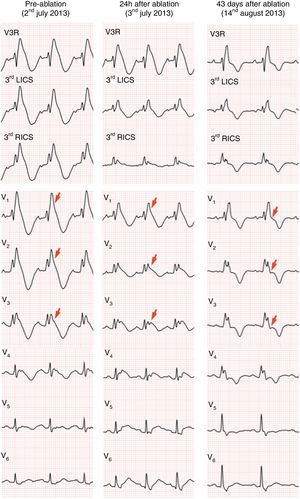
Em 2 de julho de 2013 e sem que tenha sido suspensa a terapêutica com quinidina, a doente foi submetida a estudo eletrofisiológico. Apresentava‐se em ritmo sinusal, com bloqueio bifascicular (bloqueio completo do ramo direito associado a hemibloqueio esquerdo anterior) e alteração da repolarização do tipo padrão de Brugada tipo 1 nas derivações precordiais direitas e também em derivações do plano frontal – DII, DIII e aVR (Figura 1). Documentaram‐se sístoles prematuras ventriculares monomorfas ocasionais, com morfologia de bloqueio de ramo esquerdo, eixo inferior e transição do QRS em V4, cuja frequência diminuiu espontaneamente durante o exame. Durante a estimulação ventricular programada apenas se induziram salvas de taquicardia ventricular polimórfica autolimitadas (com duração até sete segundos), sem que se precipitasse fibrilhação ventricular.
Eletrocardiograma de 12 derivações evidenciando bloqueio bifascicular (bloqueio completo do ramo direito associado a hemibloqueio esquerdo anterior), padrão de Brugada tipo 1 (com elevação convexa de ST em V1 a V4, terminando em onda T invertida), prolongamento do intervalo QT (522 ms, QT corrigido de 568 ms) e sístole prematura ventricular isolada com morfologia de bloqueio de ramo esquerdo e eixo inferior.
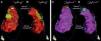
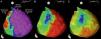
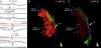
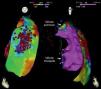
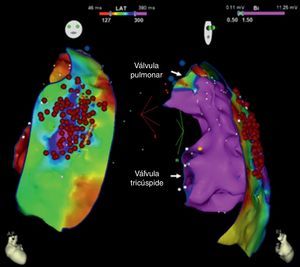
Em seguida realizou‐se mapeamento endocárdico do ventrículo direito, em ritmo sinusal, com sistema CARTO 3 (Biosense Webster, Diamond Bar, CA, EUA), utilizando cateter irrigado (Thermocool SF, Biosense Webster). Não se identificaram áreas de baixas voltagens nem zonas com prolongamento do eletrograma local além do término do QRS (Figura 2). Foi estabelecido acesso epicárdico mediante punção subxifoideia sob controlo fluoroscópico e com injeção de contraste, com posicionamento de introdutor 9 F conectado a sistema de drenagem passiva. Realizou‐se mapeamento eletroanatómico epicárdico de alta densidade do ventrículo direito (304 pontos) e das paredes anterior, lateral e posterior do ventrículo esquerdo. No mapeamento de voltagem verificaram‐se normais voltagens epicárdicas quer do ventrículo esquerdo quer da câmara de saída do ventrículo direito – Figura 3. Foi realizado o mapeamento da duração do eletrograma bipolar, o qual ocorreu no decurso do QRS em todas as regiões mapeadas do ventrículo esquerdo. Por oposição, o término do eletrograma bipolar ocorreu após o término do QRS em toda a parede anterior do ventrículo direito e identificou‐se na região anterior da câmara de saída ventricular direita uma área de 6,9 cm2 com potenciais fracionados e de longa duração (até 370 ms), prolongando‐se até 216 ms após o término do QRS de superfície (Figuras 3 e 4, Material Suplementar – Vídeo 1). Nessa área, apesar de os eletrogramas exibirem maioritariamente voltagem normal, as componentes fracionadas e tardias apresentavam voltagem diminuída (< 1 mV). O marcado prolongamento da despolarização epicárdica contrastou com a duração normal da despolarização na região endocárdica correspondente (Figura 4 e Material Suplementar – Vídeo 2).
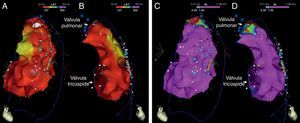
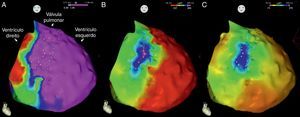
Mapas endocárdicos do ventrículo direito. Mapeamento do tempo decorrido até ao término do eletrograma bipolar local, com representação das vistas ântero‐posterior (A) e lateral direita (B): ativação endocárdica das regiões endocárdicas terminou no decurso do QRS de superfície (este terminou 127 ms após a referência do mapa), estando as mesmas coloridas a vermelho. Mapeamento da voltagem bipolar, com representação das vistas ântero‐posterior (C) e lateral direita (D): todas as regiões endocárdicas do ventrículo direito exibiram voltagem normal (> 1,5 mV), estando as mesmas coloridas a rosa.
Mapas epicárdicos em vistas ântero‐posteriores do coração. (A) Mapeamento da voltagem bipolar: documentaram‐se voltagens normais (> 1,5 mV, zonas coloridas a rosa) em todas as regiões epicárdicas do ventrículo esquerdo e na câmara de saída ventricular direita (as regiões com menores voltagens correspondem aos planos valvulares pulmonar e tricúspide; não foi avaliada a voltagem na região epicárdica apical). (B) Mapeamento do tempo decorrido até ao término do eletrograma bipolar local e (C) mapeamento da duração do eletrograma bipolar local. Os eletrogramas registados no ventrículo esquerdo tiveram duração normal e terminaram no decurso do QRS de superfície. Identificou‐se na região anterior da câmara de saída ventricular direita uma área de 6,9 cm2 com potenciais fracionados (pontos rosa claro), de longa duração (até 370 ms) e prolongando‐se até 216 ms após o término do QRS.
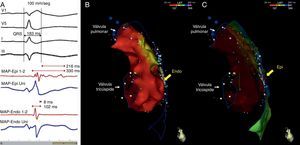
Dispersão endo‐epicárdica da duração do potencial de ação na região anterior da câmara de saída ventricular direita. (A) Eletrogramas bipolares e unipolares epicárdicos (MAP‐Epi) e endocárdicos (MAP‐Endo) registados em localizações contíguas, assinaladas nas vistas em perfil direito dos mapas mapa endocárdico (B) e epicárdico (C) do ventrículo direito. O marcado prolongamento da despolarização epicárdica (duração de 330 ms, com persistência de eletrograma até 216 ms além do término do QRS) contrastou com a duração normal da despolarização na região endocárdica correspondente (102 ms).
Realizaram‐se aplicações de energia de radiofrequência por via epicárdica (em modo de controlo de potência e com limite de energia de 35 Watts) na região anterior da câmara de saída ventricular direita, cobrindo toda a área com término tardio dos eletrogramas locais (duração total das aplicações: 34 minutos) – Figura 5. Foram eliminados os potenciais fracionados e verificou‐se ligeira redução das alterações da repolarização em V2‐V3, mas mantendo‐se padrão de Brugada no eletrocardiograma de superfície. Foi repetido o protocolo de estimulação ventricular programada, com precipitação de salvas de taquicardia ventricular polimórfica com duração comparável à induzida previamente à ablação, sem que se precipitasse fibrilhação ventricular.
Durante as primeiras 48 horas após a ablação, a doente manteve extrassistolia ventricular frequente, predominantemente monomórfica, sem outros eventos disrítmicos. Teve alta hospitalar sob propranolol (30 mg/dia), tendo sido suspensa a medicação com quinidina.
Na avaliação clínica após seis meses, apresentava‐se assintomática. Desde o procedimento, não voltara a ter episódios de palpitações, lipotimia ou síncope e não tinham sido registadas quaisquer disritmias ventriculares pelo cardioversor‐desfibrilhador. No Holter, registaram‐se apenas 48 sístoles prematuras ventriculares bimorfas e isoladas. O eletrocardiograma ao 43.° dia após a ablação revelou persistência do bloqueio completo do ramo direito, mas modificação relevante da repolarização, deixando de exibir o padrão de Brugada prévio (Figura 6).
DiscussãoO espetro clínico da síndrome de Brugada é amplo, desde os indivíduos assintomáticos até à morte súbita cardíaca devida à ocorrência de fibrilhação ventricular, a qual pode ser um evento tardio e constituir a manifestação inaugural da doença. Outras manifestações comuns são a síncope, convulsões e respiração agónica durante o sono, devidos a episódios autolimitados de taquicardia ventricular polimórfica/fibrilhação ventricular. Até recentemente, a única estratégia eficaz para a prevenção da morte súbita nestes doentes era a implantação de cardioversor‐desfibrilhador, a qual se considera recomendada nos doentes de alto risco: indivíduos sintomáticos e naqueles que tenham sobrevivido a eventos disrítmicos ventriculares prévios8. No entanto, a incidência a longo prazo de complicações é particularmente elevada, ocorrendo em até 1/3 dos casos (sendo a mais frequente das quais a ocorrência de choques inapropriados)9–11. Por outro lado, apesar de o cardioversor‐desfibrilhador ser muito eficaz no tratamento dos episódios de fibrilhação ventricular, não é capaz de prevenir a sua ocorrência, pelo que não influi favoravelmente na qualidade de vida destes doentes. Assim, nos doentes com episódios muito frequentes, como era o caso desta doente, a única opção residia na instituição de terapêutica com quinidina12, um bloqueador potente da corrente Ito. No entanto, este fármaco tem efeitos adversos muito frequentes, o que também nesta doente limitou a sua titulação posológica. Além disso, a doente continuou a ter recorrências muito frequentes de disritmias ventriculares com impacto relevante na sua qualidade de vida. Por isso, foi decidida a tentativa de ablação.
Têm sido apresentados vários estudos de pequena dimensão3,7 (< 10 doentes) e reportados casos clínicos4–6 em que foi tentada ablação para prevenção da fibrilhação ventricular em doentes com síndrome de Brugada. Os primeiros estudos utilizaram uma estratégia de ablação endocárdica focal de sístoles prematuras ventriculares3–6, que se admitem constituir um importante fator precipitante das disritmias ventriculares nestes doentes. Nestes casos, a origem das sístoles prematuras ventriculares foi identificada em diferentes regiões da câmara de saída ventricular direita e a aplicação local de energia de radiofrequência teve sucesso variável na prevenção de recorrências. Esta estratégia apresenta relevantes limitações pela natureza esporádica das sístoles prematuras ventriculares, frequentemente inexistentes no decurso do estudo eletrofisiológico, e pela possibilidade de coexistirem sístoles prematuras ventriculares sem relevância fisiopatológica com morfologias adicionais e origens distintas. Notavelmente, o primeiro caso descrito de abolição do padrão eletrocardiográfico de Brugada como resultado da aplicação de energia de radiofrequência ocorreu num doente em quem a inexistência de sístoles prematuras ventriculares durante o exame obrigou ao recurso a estratégia de pace‐mapping e à realização de ablação de área alargada, sugerindo que a modificação alargada do substrato poderia ter nestes doentes potencial curativo5.
Em 2007, Morita et al.13 analisaram a utilidade da ablação por radiofrequência no tratamento das arritmias ventriculares num modelo animal de síndrome de Brugada. Apesar de a estratégia utilizada ter continuado a centrar‐se na ablação de sístoles prematuras ventriculares, este trabalho teve o mérito de alertar para a relevância fisiopatológica do epicárdico. Os autores verificaram que o aparecimento do padrão de Brugada era simultâneo ao desenvolvimento de heterogeneidade na morfologia e duração dos potenciais de ação epicárdicos, sem que se observassem modificações nos registos endocárdicos. Documentaram o subsequente aparecimento de sístoles prematuras ventriculares, distribuindo‐se os múltiplos focos numa área alargada do epicárdio (6,1 ± 1,4 cm2), e finalmente a precipitação de taquicardia ventricular polimórfica. Os autores demonstraram que a aplicação epicárdica (mas não endocárdica) de radiofrequência prevenia a recorrência das taquidisritmias. No entanto, e em concordância com as observações clínicas, destacaram que para atingir esse efeito eram necessárias aplicações em área alargada, ou seja, uma modificação ampla do substrato.
Em 2011, Nademanee et al.7 conduziram um estudo pioneiro em que numa série de nove doentes com síndrome de Brugada e recorrências frequentes de fibrilhação ventricular, realizaram mapeamento endocárdico e epicárdico da câmara de saída ventricular direita. À semelhança do que observámos no presente caso clínico, não havia alterações da voltagem ou da duração dos eletrogramas no endocárdio, mas identificavam‐se áreas na parede anterior da câmara de saída ventricular direita com potenciais anómalos, caracterizados pela sua baixa voltagem (≤ 1 mV), fracionamento e longa duração (> 80 ms), prolongando‐se muito além do término do QRS de superfície. Nesse estudo, os autores realizaram o mapeamento da duração do eletrograma bipolar local. No nosso caso, optámos por mapear o tempo até ao término do eletrograma bipolar assumindo como referência o eletrocardiograma de superfície e ajustando a limite inferior da janela de interesse do mapa para o término do QRS (Figura 3‐B). Reanalisámos o mapa empregando a metodologia descrita por Nademanee7 e os resultados foram similares (Figura 3‐C). No estudo de Nademanee et al.7 verificou‐se que a ablação epicárdica da área de potenciais anómalos induziu normalização do padrão de Brugada em sete dos nove doentes, tendo a modificação eletrocardiográfica em três desses casos ocorrido durante o seguimento clínico, como sucedeu na nossa doente. À semelhança do que sucedeu com o caso clínico aqui reportado, nenhum dos doentes incluídos nessa série voltou a ter recorrências de taquicardia ventricular polimórfica ou fibrilhação ventricular.
O padrão eletrocardiográfico observado nesta doente caracterizou‐se pela presença da alteração da repolarização tipo 1 de Brugada não apenas nas derivações precordiais direitas, como também em aVR e nas derivações inferiores. Recentemente, foi notado que a presença destas alterações em derivações do plano frontal constitui um potente preditor do risco nos doentes com síndrome de Brugada14. Este caso clínico ilustra também a imprevisível natureza das sístoles prematuras ventriculares enquanto alvo da estratégia de ablação na síndrome de Brugada. De facto, não obstante esta doente ter extrassistolia ventricular monomórfica frequente com morfologia sugestiva de origem na câmara de saída ventricular direita, as sístoles prematuras espontaneamente desapareceram durante o estudo eletrofisiológico, provavelmente em relação com o estado de sedação. Além disso, a administração de isoprenalina frequentemente utilizada para aumentar a incidência das extrassístoles não será previsivelmente adequada neste contexto, visto ser reconhecido o seu efeito antiarrítmico na síndrome de Brugada. Merecerá ainda destaque a aparente dissociação entre a eficácia a longo prazo da estratégia de modificação do substrato, traduzida no desaparecimento do padrão eletrocardiográfico de Brugada e na prevenção das disritmias ventriculares, e a sua aparente ineficácia na eliminação a curto prazo da extrassistolia ventricular. Relembre‐se que a monitorização eletrocardiográfica durante as 48 horas pós‐ablação revelou que a extrassistolia ventricular monomorfa reapareceu após o exame e manteve‐se constante durante todo esse período. De resto, foi essa constatação que justificou a instituição de propranolol, apesar da suspensão da quinidina. Na reavaliação durante o seguimento constatou‐se desaparecimento também da extrassistolia, pelo que se suspendeu também esse fármaco.
Importará finalmente reconhecer que existem potenciais limitações à estratégia de ablação epicárdica centrada na modificação do substrato eletrofisiológico. Foi recentemente observado que o prolongamento dos eletrogramas na câmara de saída ventricular direita é dinâmico. Num doente com história de fibrilhação ventricular mas sem padrão espontâneo de Brugada tipo 1, foi mapeado o epicárdio da câmara de saída ventricular direita e identificada a área com potenciais fracionados e de menor voltagem. Seguidamente, durante a administração de ajmalina, observou‐se que a modificação eletrocardiográfica (aparecimento de padrão tipo 1) ocorria concomitantemente ao progressivo prolongamento dos eletrogramas locais15. A natureza dinâmica das alterações da despolarização no epicárdio dos doentes com síndrome de Brugada torna mais difícil a identificação de quão vasta terá que ser a modificação do substrato para atingir a eficácia clínica ou, eventualmente, para atingir intenção curativa. Além disso, num estudo envolvendo mapeamento por sistema sem contacto (Ensite 3000), em que a localização do substrato epicárdico foi extrapolada a partir da análise dos eletrogramas unipolares virtuais endocárdicos, sugeriu‐se que o prolongamento da despolarização além do término do QRS de superfície poderá ter localizações na câmara de saída ventricular não passíveis de acesso epicárdico, como a região septal16.
Reconhecemos que o seguimento do caso clínico apresentado é ainda reduzido, o que nos impede de tirar conclusões definitivas quanto à eficácia do procedimento efetuado. No entanto, a abolição do padrão de Brugada e a inexistência de quaisquer eventos disrítmicos numa doente em quem os mesmos eram extremamente frequentes, sugerem que a ablação epicárdica dos potenciais anómalos, fracionados e prolongados, na câmara de saída ventricular direita, além de ser segura foi eficaz.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.