A metaiodobenzilguanidina (MIBG) é um falso neurotransmissor análogo da noradrenalina, captada essencialmente por um mecanismo de transporte de tipo 1 na membrana celular dos neurónios adrenérgicos pré-sinápticos, acumulando-se em grânulos de armazenamento de catecolaminas. Como praticamente não é metabolizada, a sua marcação com um radioisótopo (iodo-123) permite, através de imagens cintigráficas, avaliar de forma não invasiva o status funcional da inervação simpática de órgãos com importante componente adrenérgico, incluindo o coração. A sua aplicabilidade em cardiologia nuclear tem vindo a ser estudada e parece revelar importância na avaliação de patologias como a doença arterial coronária, insuficiência cardíaca, arritmias e morte súbita.
A insuficiência cardíaca é um problema à escala global, com uma prevalência estimada nos países desenvolvidos de 2%. Apresenta uma mortalidade elevada, sendo a morte súbita cardíaca a principal causa. A disfunção do sistema nervoso autónomo, nomeadamente a hiperatividade simpática, que acompanha a insuficiência cardíaca crónica, relaciona-se com a remodelação progressiva do miocárdio, o declínio da função ventricular esquerda e o agravamento dos sintomas, participando no desenvolvimento de arritmias ventriculares e morte súbita.
Dado que a cintigrafia cardíaca com 123I-MIBG permite a identificação de alterações do sistema adrenérgico cardíaco, questiona-se o seu papel na obtenção de informação diagnóstica e prognóstica em doentes com insuficiência cardíaca.
Pelo interesse e a atualidade do assunto, pareceu-nos oportuno rever os dados publicados sobre a utilização da cintigrafia com 123I-MIBG na estratificação do risco de morte súbita em pacientes com insuficiência cardíaca.
Metaiodobenzylguanidine (MIBG) is a false neurotransmitter noradrenaline analogue that is taken up by the ‘uptake 1’ transporter mechanism in the cell membrane of presynaptic adrenergic neurons and accumulates in catecholamine storage vesicles. Since it is practically unmetabolized, it can be labeled with a radioisotope (iodine-123) in scintigraphic exams to noninvasively assess the functional status of the sympathetic innervation of organs with a significant adrenergic component, including the heart. Studies of its application in nuclear cardiology appear to confirm its value in the assessment of conditions such as coronary artery disease, heart failure, arrhythmias and sudden death.
Heart failure is a global problem, with an estimated prevalence of 2% in developed countries. Sudden cardiac death is the main cause of its high mortality. The autonomic nervous system dysfunction, including sympathetic hyperactivity, that accompanies chronic heart failure is associated with progressive myocardial remodeling, declining left ventricular function and worsening symptoms, and contributes to the development of ventricular arrhythmias and sudden death.
Since 123I-MIBG cardiac scintigraphy can detect changes in the cardiac adrenergic system, there is considerable interest in its role in obtaining diagnostic and prognostic information in patients with heart failure.
In this article we present a literature review on the use of 123I-MIBG scintigraphy for risk stratification of sudden death in patients with heart failure.
A insuficiência cardíaca (IC) constitui uma síndrome clínica com uma prevalência mundial estimada de 2 a 3%1. Em Portugal, a prevalência global é de 4,36%, aumentando com a idade, sendo que, acima dos 80 anos, se estima uma prevalência de 16,14%2. Apesar dos avanços registados ao nível da terapêutica e controlo, o número de doentes com IC tem aumentado, acompanhando o envelhecimento da população dos países desenvolvidos3.
A IC sistólica surge na sequência de um evento que lesa o miocárdio e que se acompanha de um declínio da função cardíaca que ativa mecanismos compensatórios fundamentais à preservação da homeóstase cardiovascular que, numa fase inicial, contribuem para a manutenção da frequência cardíaca (FC), pressão arterial (PA) e débito cardíaco (DC), mantendo o doente assintomático3,4. Os principais sistemas envolvidos são o eixo renina-angiostensina-aldosterona (RAA), o sistema nervoso simpático (SNS) e as citoquinas, que, quando cronicamente ativados, determinam consequências estruturais e de performance cardíacas, que acompanham a progressão da doença4. A ativação crónica destes sistemas condiciona hipertrofia e apoptose dos miócitos, proliferação fibroblástica e acumulação intersticial de colagénio, promovendo a remodelagem miocárdica e a disfunção contrátil cardíaca, que condicionam a diminuição do volume de ejeção3. Consequentemente, aumenta a suscetibilidade para o desenvolvimento de arritmias e morte súbita5. Por outro lado, na IC diastólica, a fração de ejeção ventricular esquerda (FEVE) encontra-se preservada, estando em causa a disfunção diastólica1,3,6.
A morte súbita cardíaca (MSC) constitui umas das principais causas de mortalidade associada à IC7, correspondendo a cerca de 30 a 50% de todas as mortes8. Na sua origem encontram-se sobretudo as alterações rítmicas como a taquicardia ventricular (TV), a fibrilhação ventricular (FV) e as bradiarritmias, nas quais o sistema nervoso autónomo (SNA) apresenta um papel central9,10. De facto, tem vindo a ser demonstrado que os efeitos eletrofisiológicos e potencialmente arritmogénicos das catecolaminas são uma das principais causas de TV e morte súbita em doentes com disfunção autonómica e hiperatividade simpática11.
Os efeitos pró-arrítmicos da IC, relacionados com alterações na concentração de cálcio intracelular e do tónus do SNA, predispõem a taquiarritmias e as bradiarritmias que podem culminar em paragem cardíaca e morte súbita12. Nas primeiras, a sequência elétrica mais comum corresponde a TV que degenera em FV, situações mais frequentemente observadas no contexto de cardiopatias dilatadas e disfunção ventricular com FEVE diminuída13.
Atualmente, a decisão de implantar um cardioversor desfibrilhador (CDI) depende do valor da FEVE e da classe funcional da IC, que são os parâmetros mais utilizados para definir o risco de MSC14. A sua aplicação tem implicações importantes. Por um lado, o risco de morte por arritmias não é igual em doentes com o mesmo valor de FEVE; por outro lado, doentes com FEVE muito baixa apresentam maior risco para morte não arrítmica e, por isso, não beneficiam de CDI12. Acredita-se que apenas um terço das MSC apresenta um comprometimento da FEVE que se enquadra nos critérios atuais para tratamento profilático com CDI15. Além disso, cerca de dois terços dos doentes que poderiam beneficiar de terapêutica profilática acabam por ser vítimas de MSC, dado que os valores de FEVE não se enquadram nos critérios10. Assim, conclui-se que a FEVE é um marcador de risco de morte súbita insuficiente, o que permite explicar o aumento da prevalência de morte súbita apesar da terapêutica com CDI. Surge, portanto, a necessidade de encontrar novos marcadores mais eficazes e específicos para a estratificação do risco de morte súbita e que permitam uma melhor seleção dos candidatos à terapêutica com CDI. A utilização da cintigrafia com iodo-123-metaiodobenzilguanidina (123I-MIBG) tem sido amplamente analisada neste sentido.
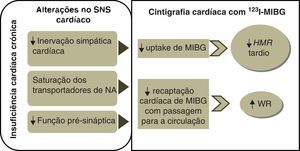
A metaiodobenzilguanidina (MIBG) resulta da modificação química da guanetidina, um falso neurotransmissor análogo da noradrenalina (NA)16, que é captada pelos neurónios adrenérgicos pré-sinápticos por um mecanismo de transporte do tipo i (processo ativo, mediado por proteína, sódio e energia, dependente de temperatura)16,17. Depois de captado, o MIBG é transportado para vesículas de armazenamento de catecolaminas17 e, como não é metabolizado pela monoamino-oxidase (MAO) ou pela catecol-O-metiltransferase (COMT), mantém uma concentração citoplasmática mais elevada do que a NA16. Desta forma, quando combinado com um composto radioativo, as imagens cintigráficas de captação e washout do MIBG permitem a caracterização da função simpática cardíaca e a integridade dos neurónios adrenérgicos18. A marcação do MIBG com o iodo-123 (123I) permite obter, através de câmaras gama, e de forma minimamente invasiva, imagens planares ou tomográficas (single photon emission computed tomography [SPECT]) e é através destas que são calculados 2 parâmetros semiquantitativos fundamentais – relação coração/mediastino (heart-mediastinum ratio [HMR]) e washout rate do miocárdio (WR)19. Estes parâmetros podem refletir diretamente a libertação de NA das terminações nervosas e a sua recaptação (uptake-1), verificando-se que a concentração local de NA na fenda sináptica aumenta quando há aumento do WR e/ou diminuição do HMR18.
Modificações no sistema nervoso simpático cardíaco e imagens com iodo-123-metaiodobenzilguanidinaA ICC acompanha-se de uma hiperatividade do SNS, cerca de 50 vezes superior ao normal, que constitui um mecanismo compensatório para o défice funcional cardíaco que acompanha esta síndrome20,21. A ativação do SNS constitui uma resposta hemodinâmica de defesa, que é fundamental numa fase inicial de IC, mas que, a longo prazo, acarreta consequências importantes, como a remodelação estrutural associada a apoptose dos miócitos, fibrose e dilatação ventricular e maior risco de instabilidade elétrica com progressiva deterioração funcional2. O aumento da atividade adrenérgica cardíaca acompanha-se de um aumento da concentração de NA. Numa fase inicial de IC, o aumento da NA é local21. Com a progressão da doença, o aumento excessivo da NA nas fendas sinápticas esgota a capacidade de ligação aos recetores e de recaptação, o que promove o outflow de NA do coração para os tecidos periféricos, contribuindo para o aumento da sua concentração plasmática21.
A hiperatividade adrenérgica, a longo prazo, contribui também para uma dessensibilização e redução significativa da expressão dos transportadores, o que conduz ao aumento dos níveis de NA sináptica22 e ao esgotamento das vesículas de armazenamento de NA23, ocorrendo o declínio da inervação simpática miocárdica20. Com a redução da concentração de catecolaminas miocárdicas surge também a dessensibilização seletiva dos recetores β-adrenérgicos23, com alteração da relação entre os adrenorecetores β1 e β24, no sentido da diminuição da densidade de recetores β1 e aumento dos β2 e β3 (cerca de 2 a 3 vezes o normal)24. De uma forma geral, as alterações que ocorrem na densidade e atividade dos recetores β-adrenérgicos promovem a hiperplasia fibroblástica, a apoptose de cardiomiócitos e a instabilidade elétrica24.
O excesso de catecolaminas miocárdicas altera os mecanismos eletrofisiológicos, promovendo oscilações dos potenciais de membrana com alterações da condução elétrica e a promoção de mecanismos de reentrada que alteram a excitabilidade cardíaca e predispõem à ocorrência de taquiarrtimias fatais25.
Um estudo desenvolvido por Rocca et al. estudou a associação da hiperatividade simpática cardíaca à morte súbita e ao agravamento da IC em doentes com disfunção sistólica26. Concluiu que o aumento da atividade adrenérgica se associa a pior prognóstico e constitui um fator de risco para a ocorrência de morte súbita26. O aumento de NA armazenada nos cardiomiócitos, a concentração de NA arterial e o excesso de NA corporal foram ainda considerados importantes fatores de risco para MSC26.
A cintigrafia cardíaca com 123I-MIBG permite, através da análise da sua captação e washout, a caracterização da integridade neuronal e a função simpática do coração18,19, dado que, 3 a 4 h após a injeção intravenosa do composto marcado radioativamente, é possível obter imagens que traduzem a sua captação neuronal.
As imagens precoces, obtidas 15 a 30 min após injeção de 123I-MIBG, caracterizam a captação intersticial, enquanto as imagens tardias representam a captação neuronal, sendo, por isso, as mais utilizadas para análise e interpretação27. A interpretação das imagens consiste na avaliação da captação global de 123I-MIBG nas imagens planares e do seu washout, entre as imagens precoce e tardia. Para tal, são calculados 2 índices semiquantitativos – a HMR e o WR.
O HMR obtido a partir das imagens tardias constitui a medida padrão da captação de 123I-MIBG, refletindo a distribuição relativa dos terminais nervosos simpáticos cardíacos19. Para o seu cálculo, define-se uma região de interesse sobre o coração, a parede do ventrículo esquerdo, e outra no terço superior do mediastino. Nas imagens planares tardias, determina-se a contagem média por píxel dessas regiões, dividindo-se o valor da contagem cardíaca pela mediastínica19. O valor normal varia entre 1,8 e 2,8 (média 2,2±0,3), revelando localização miocárdica predominante do MIBG que ocorre em corações normais27. Uma captação cardíaca diminuída traduz-se por uma redução do HMR que revela menor densidade de recetores adrenérgicos cardíacos27. O HMR calculado através das imagens precoces reflete provavelmente a integridade dos neurónios adrenérgicos pré-sinápticos, enquanto o HMR tardio retrata a função neuronal desde a captação até à libertação de 123I-MIBG das vesículas de armazenamento dos terminais nervosos28. O WR miocárdico de 123I-MIBG corresponde a uma percentagem que traduz a taxa de diminuição das contagens correspondentes a regiões de interesse cardíacas, obtidas nas imagens precoce e tardia. Desta forma, representa a capacidade de o miocárdio reter MIBG, dependente da integridade neuronal e do tónus simpático miocárdico19.
Diversos estudos têm vindo a comprovar a utilidade da cintigrafia com 123I-MIBG na identificação das alterações do sistema adrenérgico cardíaco que acompanham o processo fisiopatológico da IC. A avaliação destas alterações, que se manifestam por variações a nível dos parâmetros semiquantitativos (Figura 1) determinados através da cintigrafia, tem vindo a revelar importante valor prognóstico7 e de estratificação do risco7,18. Para além deste papel de estudo da condição cardíaca, a cintigrafia com 123I-MIBG permite objetivar os efeitos das intervenções terapêuticas16, assim como ajudar na definição de uma nova estratégia de tratamento.
Valor prognóstico da cintigrafia com iodo-123-metaiodobenzilguanidina na insuficiência cardíacaA primeira vez que foi demonstrado o valor prognóstico da cintigrafia cardíaca com 123I-MIBG foi em 1992, por Merlet et al., num estudo com 90 doentes com IC com FEVE < 45% e classes funcionais NYHA II, III e IV29. Merlet et al., concluíram que o nível de captação de 123I-MIBG, acedido através do HMR, se relacionava com a esperança de vida de um doente insuficiente cardíaco (com cardiomiopatia dilatada ou isquémica), sendo que doentes com HMR < 1,20 apresentavam pior prognóstico, com taxas de sobrevivência menores, comparativamente com aqueles que apresentavam HMR > 1,229. Estas observações demonstravam o importante valor prognóstico da cintigrafia cardíaca com 123I-MIBG, que se verificou ser superior ao da FEVE29. Vários autores têm recentemente confirmado e demonstrado o papel da determinação dos parâmetros cintigráficos como indicadores de prognóstico e de estratificação do risco na IC.
Uma meta-análise realizada em 2008 por Verberne et al., com 18 estudos, revelou que os parâmetros semiquantitativos obtidos por cintigrafia com 123I-MIBG pareciam marcadores promissores de prognóstico em doentes com IC sistólica30. Concluíram ainda que a diminuição do HMR tardio se associava à maior incidência de eventos cardíacos, sem se relacionar com fenómenos de morte cardíaca, e o aumento do WR surgia também associado à maior ocorrência de eventos cardíacos, incluindo a morte cardíaca30.
Em 2009, um estudo de Tamaki et al., com o objetivo de comparar o valor prognóstico dos parâmetros cintigráficos com o de outros marcadores, demonstrou que o WR é o preditor mais poderoso de morte súbita em doentes com IC leve a moderada (Tabela 1)31.
Risco de morte súbita e/ou morte cardíaca e/ou choque cardiogénico atribuído à disfunção do SNA em doentes com insuficiência cardíaca
| Número de doentes | FEVE | Follow-up | HR (95% IC) - Análise univariada de Cox | ||
| HMR tardio | WR | ||||
| Kioka et al. (2007)40 | 97 | < 40% | 65 meses | 0,065 (0,010-0,426) | 1,057 (1,023-1,091) |
| Tamaki et al. (2009)31 | 106 | < 40% | 65±31 meses | 0,131 (0,034-0,511) | 1,045 (1,017-1,074) |
| Kuramoto et al. (2010)36 | 106 | < 40% | 6,8±3,5 anos | 0,089 (0,019-0,412) | 1,052 (1,022-1,082) |
FEVE: fração de ejeção ventricular esquerda; HMR – relação coração – mediastino; HR: hazard ratio; IC: intervalo de confiança; WR: washout rate.
Em 2010, um estudo prospetivo com 64 doentes com IC com FEVE < 45% comprovou o valor prognóstico do HMR na IC crónica de causa isquémica e por cardiomiopatia dilatada idiopática32. O valor de cut-off para o HMR definido foi de 1,68, sendo que doentes com HMR < 1,68 apresentavam significativamente maior mortalidade do que aqueles com valores superiores a 1,68 (15 mortes em 29 doentes com HMR > 1,68 para 4 mortes em 36 doentes com HMR < 1,68). Para além da descrição do HMR como um marcador independente do prognóstico, a longo prazo, na IC crónica, os autores concluíram que a classe funcional NYHA e o valor de FEVE em repouso não se relacionaram com o prognóstico32. Verificaram ainda que a associação dos diferentes marcadores (classe funcional NYHA, a FEVE, a concentração plasmática de BNP e o HMR tardio) apresentava maior valor prognóstico do que qualquer um deles isoladamente32. O valor prognóstico dos resultados da cintigrafia com 123I-MIBG a longo prazo (follow-up de 10 anos), em comparação com parâmetros funcionais convencionais, foi, ainda, estudado por Momose et al. em 86 doentes com cardiomiopatia dilatada33. Concluíram que os principais critérios de mau prognóstico são a FEVE < 30%, o WR > 50% e o HMR tardio < 1,45, sendo que apenas o WR foi um indicador prognóstico independente de morte súbita33. Assim como no estudo anterior, ficou demonstrado que a combinação de variáveis tem valor prognóstico superior ao dos parâmetros cintigráficos analisados em isolado.
Em 2010, foi publicado o primeiro grande estudo prospetivo e multicêntrico – ADMIRE-HF – que incluiu 961 doentes com IC e classe funcional da NYHA II e III. As suas conclusões vieram reforçar e confirmar o papel da cintigrafia cardíaca com 123I-MIBG na avaliação da atividade adrenérgica e no prognóstico da IC de causa isquémica e não isquémica34. A análise primária dos dados deste estudo demonstrou que o valor do HMR tardio (obtido às 4 h após injeção do marcador), em imagens planares, tem importância no estabelecimento da probabilidade de ocorrência de morte cardíaca (morte súbita ou morte por falência cardíaca). O valor de cut-off estabelecido foi de 1,6, sendo que os doentes com HMR tardio ≥ 1,6 apresentavam uma probabilidade de morrer, de causa cardíaca, aos 2 anos, de 1,8%, contrastando com 11,2% se HMR tardio fosse inferior a 1,6. Neste estudo a mortalidade foi de cerca de 20% em doentes com HMR tardio inferior a 1,2. Quando comparado com 2 dos principais marcadores prognósticos - BNP e FEVE -, o HMR tardio revelou capacidade de fornecer informação complementar ao valor de BNP plasmático e FEVE para identificar doentes em maior risco de desenvolver eventos cardíacos (progressão da IC, evento arrítmico potencialmente fatal e morte cardíaca)34. Os outros parâmetros semiquantitativos obtidos por cintigrafia cardíaca, nomeadamente o HMR precoce e o WR, demonstraram também associação com o risco de desenvolvimento de eventos cardíacos. Contudo o HMR tardio foi o único que demonstrou significância estatística e valor prognóstico independente34.
Uma meta-análise recente, que teve por base estudos realizados no Japão, com o objetivo de determinar o valor prognóstico dos parâmetros cintigráficos com o MIBG, concluiu que a diminuição do HMR tardio e o aumento do WR que acompanham a IC crónica se relacionam com a ocorrência de eventos fatais35. Entre os diversos estudos analisados, foi consensual a utilização do HMR tardio como preditor do prognóstico em IC crónica, o que vai ao encontro dos dados anteriormente referidos35.
Na definição do prognóstico da IC, o modelo de Seattle é um modelo validado para a estimativa da mortalidade total de doentes com IC crónica. Um estudo de Kuramoto et al. (2011) investigou o potencial da cintigrafia com 123I-MIBG em providenciar informação prognóstica adicional ao modelo de Seattle36. Em 106 doentes com IC da classe NYHA I-III, com FEVE < 40%, foi calculado o score do modelo de Seattle individual e realizadas imagens planares de cintigrafia com 123I-MIBG e foram registadas as mortes cardíacas (MSC, morte por falência cardíaca e morte cardíaca de outras causas, como enfarte agudo de miocárdio) durante um follow-up médio de 6,8 anos36. A análise multivariada Cox revelou que o score obtido através do modelo de Seattle e o WR de MIBG são variáveis independentes relacionadas com o risco de morte cardíaca. Demonstrou-se ainda que o WR de MIBG providencia informação prognóstica, a longo prazo, adicional ao modelo de Seattle, e constitui o único fator capaz de predizer, de forma independente, o risco de morte súbita. Assim, a combinação de ambos os parâmetros revela maior sensibilidade na identificação de doentes com IC crónica que apresentam maior risco de morte36.
As informações relativas ao valor prognóstico da cintigrafia cardíaca com 123I-MIBG apresentadas até este ponto aplicam-se à IC com diminuição da FEVE, mas questiona-se o papel desta técnica de neuroimagem na avaliação da IC com FEVE preservada.
Com o objetivo de estimar a utilidade da cintigrafia com 123I-MIBG na avaliação do prognóstico da IC com FEVE preservada, foi realizado, por Katoh et al. (2010), um estudo prospetivo com 117 doentes com IC com FEVE ≥ 50%, nos quais foram considerados eventos, a morte (morte por agravamento da IC ou morte súbita) e o agravamento clínico com readmissão hospitalar num período de 1 025 d37. Concluiu-se que, à semelhança da IC com FEVE < 50%, a patogénese da IC com FEVE ≥ 50% encontra-se relacionada com uma hiperatividade cardíaca simpática e, que por isso, os parâmetros da cintigrafia cardíaca com 123I-MIBG teriam um papel na definição do prognóstico destes doentes. De entre os parâmetros cintigráficos, o que revelou melhor valor prognóstico foi o WR, sendo que foi considerado o único preditor independente de eventos cardíacos futuros37. Apesar de FEVE dentro de valores normais, estes doentes apresentam um prognóstico reservado. Veja-se, por exemplo, no estudo de Katoh et al. (2010), dos 117 doentes, 42 (aproximadamente 36% dos doentes) sofreram eventos cardíacos durante um período de cerca de 3 anos37. A cintigrafia com 123I-MIBG parece assim constituir um método útil na avaliação do prognóstico dos pacientes com IC e FEVE preservada. Deverão ser realizados estudos adicionais no sentido de determinar a aplicabilidade da cintigrafia.
Cintigrafia com iodo-123-metaiodobenzilguanidina na avaliação prévia à implantação de cardiodesfibrilhador em doentes com insuficiência cardíacaAs alterações que ocorrem a nível do SNS cardíaco têm sido estudadas como possíveis marcadores de estratificação do risco de MSC, podendo com isso contribuir para uma melhor seleção de candidatos a CDI. Vários estudos têm vindo a demonstrar a capacidade da cintigrafia cardíaca com 123I-MIBG em identificar doentes com maior risco de desenvolver taquiarritmias ventriculares espontâneas11, choques apropriados de CDI38,39 e MSC (Tabela 1)9,31,34,36,40.
O primeiro estudo a avaliar o valor da cintigrafia com 123I-MIBG na predição de morte súbita em IC foi realizado por Kioka et al. em 200740. Neste estudo prospetivo com 97 doentes com IC leve a moderada, com FEVE < 40%, foi demonstrada a existência de uma associação entre os parâmetros cintigráficos e a MSC40. Apenas o WR de MIBG foi identificado como preditor independente de morte súbita, comparativamente com o HMR, a FEVE e a classe funcional NYHA40. Mais tarde, outros estudos vieram confirmar estas evidências e o WR tem vindo a ser demonstrado como um importante preditor de eventos arrítmicos ventriculares9 e MSC31,33,36.
Os estudos que têm como objetivo estudar fenómenos de morte súbita são de difícil definição, já que esta constitui um acontecimento inesperado e a sua causa nem sempre é possível de esclarecer. Para contornar este problema, os estudos que pretendem analisar situações arrítmicas potencialmente fatais poderão ser desenhados em doentes que se encontram em terapêutica profilática com CDI. Com base neste princípio, realizaram-se múltiplos estudos com o objetivo de identificar o papel da cintigrafia cardíaca na avaliação do risco de taquiarritmias ventriculares9 e morte súbita38,39,41.
Nagahara et al. (2008), num estudo prospetivo com 54 doentes com CDI, observaram que o HMR apresentava capacidade para prever choques e para estratificar o risco de MSC, independentemente da FEVE e da concentração plasmática de BNP38. Por outro lado, a atividade do MIBG, determinada por cintigrafia cardíaca, permitia identificar doentes em elevado e baixo risco de desenvolver eventos cardíacos (morte súbita e taquiarritmias ventriculares que conduzem a choques apropriados), falhando na identificação dos doentes de risco intermédio38. Esta lacuna era colmatada pela associação dos parâmetros cintigráficos com outros marcadores, nomeadamente a concentração plasmática de BNP e a FEVE38. Assim, Nagahara et al. definiram 3 variáveis que contribuíam para identificar doentes com maior risco de MSC, nos quais a terapêutica com CDI estaria indicada: HMR (cut-off de 1,95); concentração plasmática de BNP (cut-off de 187pg/mL) e FEVE (cut-off de 50%)38. A evidência de que o HMR tardio poderá ser um bom marcador de risco de morte súbita em doentes com IC foi também demonstrada no estudo ADMIRE-HF, publicado em 201034. Neste estudo multicêntrico, Jacobson et al. observaram que eventos arrítmicos, incluindo eventos arrítmicos não fatais e morte súbita, foram mais frequentes em doentes com HMR tardio inferior a 1,6034.
Para além do reconhecimento de que o comprometimento da atividade nervosa simpática miocárdica contribui para eventos arritmogénicos e de morte súbita, em doentes com IC, um outro fenómeno que se relaciona é a existência de alterações na perfusão e inervação do tecido miocárdico. Encontra-se relatado que a heterogeneidade regional da perfusão e inervação simpática intervém na génese de fenómenos arrítmicos, principalmente em doentes com história de cardiopatia isquémica27. Um estudo prospetivo recente de Nishisato et al. investigou as implicações prognósticas da cintigrafia cardíaca com 123I-MIBG em associação a estudos de perfusão miocárdica, confirmando a existência de uma relação do comprometimento da inervação e da perfusão miocárdica com eventos arrítmicos e morte súbita41. Estes dados indicam que a combinação de técnicas de avaliação da perfusão e da inervação adrenérgica contribuem para identificar doentes em maior risco de taquiarritmias e morte súbita.
O valor prognóstico dos parâmetros derivados de imagens planares da cintigrafia cardíaca com 123I-MIBG encontra-se relatado em múltiplos estudos. Pelo contrário, as imagens de SPECT são pouco estudadas havendo poucas referências quanto ao seu uso na avaliação da inervação simpática cardíaca e seu valor preditivo. Um estudo recente desenvolvido por Boogers et al. avaliou o papel da cintigrafia com 123I-MIBG na previsão de arritmias ventriculares em doentes propostos para tratamento com CDI39. Antes da colocação do dispositivo, foram obtidas imagens planares e de SPECT cardíaco com 123I-MIBG nos 116 doentes envolvidos39. Os autores observaram que a desinervação simpática miocárdica observada nas imagens de SPECT era preditiva de arritmias ventriculares, permitindo melhorar a estratificação do risco de morte por arritmias em doentes referenciados para CDI39. Com este estudo surge então um possível novo critério prognóstico: a desinervação miocárdica traduzida pela extensão do defeito do MIBG nas imagens de SPECT.
Considerações finaisA mortalidade associada à IC por MS é elevada, apesar dos progressos terapêuticos e de intervenções profiláticas.
A cintigrafia cardíaca com 123I-MIBG constitui um instrumento que faculta a demonstração de alterações do SNS cardíaco, com potencial na avaliação de doentes com IC e na seleção de doentes para CDI.
A sua aplicação no contexto clínico depende da realização de estudos multicêntricos prospetivos com amostras corretamente dimensionadas e ajustadas ao tempo de seguimento clínico, incluindo também doentes com IC e FEVE preservada. Para além da evidência científica, importa considerar o custo do exame e a sua exigência técnica que constituem, sem dúvida, importantes limitações à sua generalização.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que, para esta investigação, não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.