A síndroma de Sneddon é uma entidade rara caracterizada pela associação de doença cerebrovascular isquémica e livedo reticularis. Os autores apresentam um caso de acidente vascular cerebral isquémico e enfarte do miocárdio em doente com síndroma de Sneddon e síndroma antifosfolipídica, que posteriormente reuniu alguns critérios de lúpus eritematoso sistémico, salientando a complexidade do envolvimento cardiovascular nas doenças sistémicas.
Sneddon syndrome is a rare clinical entity characterized by the association of ischemic cerebrovascular disease and livedo reticularis. The authors report a case of stroke and myocardial infarction in a 39‐year‐old man with Sneddon syndrome and antiphospholipid syndrome who subsequently met some criteria for systemic lupus erythematosus, highlighting the complexity of cardiovascular involvement in systemic diseases.
A síndroma de Sneddon (SS) é uma entidade clínica rara, de incidência anual estimada em quatro por milhão1, acometendo mais frequentemente mulheres de idade entre os 20‐42 anos, com raros casos descritos na infância ou após os 65 anos1. Descrito por Sneddon em 1965, esta síndroma caracteriza‐se pela associação de doença cerebrovascular isquémica a livedo reticularis (LR), devido a fenómenos oclusivos progressivos em artérias de médio e pequeno calibre1–3. Outros órgãos e sistemas podem ser acometidos por esta doença, encontrando‐se descrita a afeção do sistema cardiovascular com manifestações como hipertensão arterial, isquemia miocárdica e lesões valvulares mitrais (mais frequentes) ou aórticas, com ou sem regurgitação associada1,2. Outros sistemas também podem ser afetados pelo SS, ocorrendo nomeadamente envolvimento ocular (50‐70%), gastrointestinal, renal (50‐70%) e oclusões venosas. Não foi ainda identificado um marcador específico para o SS e a sua etiologia não se encontra bem definida1–8, mas tem sido sugerido que as suas manifestações ocorrem por diminuição do fluxo sanguíneo, condicionadas por aumento da viscosidade, fenómenos trombóticos e embólicos, calcificação da parede arterial, vasculite e hiperplasia da íntima, que resultam em proliferação, recanalização e trombose de artérias de pequeno e médio calibre6.
Apesar de esta entidade ter sido inicialmente diagnosticada na ausência de doenças sistémicas, tem sido descrita a presença de anticorpos antifospolipídicos (AAF) com uma prevalência muito variável nas diferentes séries (0‐85%), assim como critérios de lúpus eritematoso sistémico (LES) ou alterações da coagulação, como a deficiência de proteína S ou mutações do fator V de Leiden1–5. Atualmente são aceites três variantes da doença: a forma idiopática – não associada a AAF ou a LES; a forma associada à síndroma antifosfolipídica (SAF); e a forma associada a LES, com ou sem AAF4.
O SAF é mais frequente no sexo feminino e o seu diagnóstico implica a presença de um critério clínico – documentação de tromboembolismo recorrente arterial e/ou venoso, associado a um critério laboratorial, com presença de AAF em dois controlos separados em pelo menos 12 semanas9,10. Tem como possíveis manifestações cardíacas a doença coronária trombótica, trombo intracardíaco ou alterações valvulares (espessamento, massas trombóticas na sua dependência, vegetações não infeciosas)9.
O LES é uma doença autoimune multissistémica, mais frequente no sexo feminino, com uma prevalência de 40 por milhão11. O seu diagnóstico implica a presença de quatro dos 11 critérios definidos pelo American College of Rheumatology, recentemente atualizados para incluírem a nefrite lúpica comprovada com biopsia associada a anticorpos antinuclerares ou antidouble strand DNA11,12. Pode associar‐se ao SAF em 10‐30% dos casos, elevando em dez vezes o risco de eventos coronários agudos9. A doença coronária isquémica é uma possível manifestação cardíaca do LES, devido a aterosclerose acelerada, embora também possa ocorrer por trombose em contexto de SAF, por embolização de vegetações não infeciosas ou, mais raramente, por arterite coronária9. Outras manifestações cardíacas do LES incluem a pericardite, o derrame pericárdico, a miocardite e a endocardite de Libman‐Sacks13.
Caso clínicoHomem de 39 anos, caucasiano, com antecedentes de tabagismo (24 unidades maço ano), hipercolesterolemia e história familiar em primeiro grau de síndroma de Sjögren (mãe). Sem história de corticoterapia prévia, de uso de esteroides anabolizantes ou de consumo de drogas. Internado no serviço de neurologia a 21 de janeiro de 2010 por AVC isquémico com hemiparesia esquerda, tendo sido objetivado LR extenso, localizado predominantemente no tronco e nos membros superiores. Não foi identificada síndroma febril nem documentada fibrilhação auricular. No período inicial do internamento (21‐01‐2010) foi realizada tomografia computorizada (TC) cranioencefálica (CE), que mostrou uma discreta hipodensidade subcortical na região frontolateral direita sugerindo natureza vascular recente, e várias pequenas hipodensidades na substância branca subcortical de ambos os hemisférios cerebrais de provável natureza vascular sequelar. O estudo imagiológico foi posteriormente (28‐01‐2010) complementado com ressonância magnética nuclear (RM) CE para despiste de etiologia desmielinizante mostrando achados compatíveis com enfarte cerebral recente em território dependente da artéria cerebral média direita (ACMD) e etiologia vascular das lesões sequelares, com a angiografia por RM a mostrar oclusão do fluxo num ramo da ACMD.
Para estudo etiológico do AVC foi realizada avaliação laboratorial (21‐01‐2010), que identificou: trombocitopenia (52‐54x103 plaquetas/μL, normal: 150‐400x103/μL), velocidade de sedimentação 34mm/1.ªh (normal: <10mm/1.ªh), anticoagulante lúpico positivo forte, anticorpos (AC) anticardiolipina IgG >280U/mL e IgM de 82U/mL e (positivo: >30U/mL), AC anti‐β2glicoproteína1 IgG de 13U/mL (positivo >12U/mL) e IgM de 46U/mL (positivo >7U/mL), AC antimitocondriais de 320U/mL (positivo >20U/mL), hipocomplementemia com C3 de 0,786g/L (normal: 0,9‐1,8g/L) e C4 de 0,049g/L (normal: 0,10‐0,40g/L), colesterol LDL de 3,01mmol/L (<2,50mmol/L), proteína C reativa de 0,8mg/dL (normal: <1mg/dL) e NT‐proBNP de 571pg/mL (elevado >1.800pg/mL). Não foram verificadas alterações nos restantes parâmetros de hemograma, função renal, provas hepáticas, outros autoanticorpos, estudo de trombofilia, serologias bacterianas e víricas realizadas (incluindo HBV, HCV e HIV), marcadores tumorais ou rastreio toxicológico. Foi realizado eco Doppler carotídeo e vertebral a 24 de janeiro de 2010 que não identificou placas de aterosclerose. Durante o internamento verificou‐se recuperação completa dos défices neurológicos. O doente teve alta do serviço de neurologia com o diagnóstico de SS associado a SAF, sob hipocoagulação oral com varfarina para INR alvo de 2‐3 e indicação para cessação tabágica. Foram ainda solicitados ecocardiogramas transtorácico (ETT) e transesofágico (ETE), com posterior referenciação do doente para consulta de cardiologia para avaliação de fonte cardioembólica do AVC, tendo em conta a idade e a localização das lesões cerebrais.
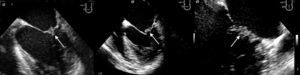
O ETT, realizado a 28 de janeiro de 2010, mostrou espessamento de ambos os folhetos e uma massa hiperecogénica e homogénea de reduzidas dimensões (0,8x0,9cm) na vertente auricular do folheto posterior da válvula mitral (VM), regurgitação mitral ligeira, ventrículo esquerdo moderadamente dilatado e com alterações da motilidade segmentar (acinésia dos segmentos basais e médios das paredes inferior e inferolateral, hipocinésia dos segmentos apicais da parede inferoseptal), com depressão moderada a grave da função sistólica global: fração de ejeção de 34% por método de Simpson biplano. O ETE, realizado no mesmo dia, permitiu excluir outras fontes cardioembólicas e caracterizar a massa da VM, que se apresentou séssil, de bordos irregulares mas bem definidos, de ecogenecidade intermédia, heterogénea e móvel acompanhando os movimentos do folheto (Figura 1). Não foi identificado contraste espontâneo nas cavidades esquerdas.
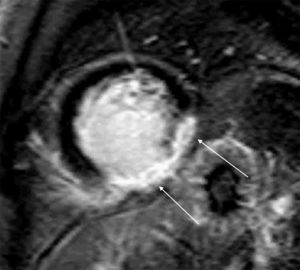
Para estudo de disfunção ventricular esquerda o doente foi ainda referenciado para realização de RM cardíaca (14‐05‐2010), que confirmou a depressão grave da função sistólica do ventrículo esquerdo (fração de ejeção: 33%). O estudo de realce tardio com gadolíneo foi sugestivo de etiologia isquémica, apresentando fibrose transmural das paredes inferior e inferolateral (Figura 3). Foi ainda visualizado um nódulo hipointenso em T2 no folheto posterior da VM, com difícil caracterização por este método de imagem atendendo às suas reduzidas dimensões.
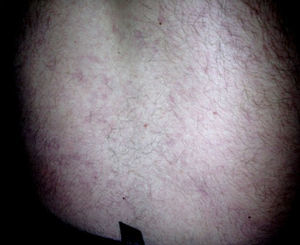
Na primeira avaliação em consulta de cardiologia, realizada quatro meses após a alta (24‐05‐2010), o doente não referia sintomas com exceção de episódio único de angor ocorrido três semanas antes (3‐05‐13), com características típicas, cinco minutos de duração, desencadeado por esforço intenso, remissão espontânea com repouso ao fim de 30 minutos, não tendo procurado cuidados de saúde. Quando questionado referia artralgias nas articulações interfalângicas proximais de ambas as mãos e história prévia de fotossensibilidade, sem episódios recentes da mesma. À observação, apresentava ainda LR embora, segundo o doente, fosse menos intenso do que na fase aguda do AVC. Apresentava coloração violácea, margens irregulares, localizava‐se na metade inferior do tronco (Figura 2). O doente referia tê‐lo há muito tempo, descrevendo que seria menos exuberante e se teria intensificado aquando do AVC. Não apresentava outras alterações ao exame objetivo, nomeadamente sequelas neurológicas. O eletrocardiograma mostrava ritmo sinusal com 70 batimentos por minuto, ondas Q e T negativas nas derivações inferiores. Trazia registos de INR dos dois meses prévios com valores entre 3,2‐3,4.
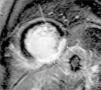
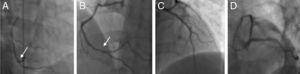
Foi dada indicação ao doente para manter cessação tabágica, iniciada após o episódio de AVC, foi medicado com ácido acetilsalicílico 100mg id, sinvastatina 20mg id, perindopri 2mg id, nevibolol 2,5mg id e nitroglicerina 5mg id, e foi referenciado para coronariografia. Esta foi realizada a 21 de junho de 2010 e mostrou irregularidades na artéria coronária direita e imagem sugestiva de trombo não oclusivo no seu segmento distal – sobretudo no início da artéria póstero‐lateral (Figura 4), com fluxo distal mantido, sem evidência de doença coronária epicárdica nas artérias descendente anterior ou circunflexa.
Coronariografia (21‐06‐2010): painéis A e B: cateterização da artéria coronária direita nas incidências anterior oblíqua direita e esquerda, respetivamente, mostrando irregularidades e imagem sugestiva de trombo não oclusivo no seu segmento distal (seta branca).
Painéis C e D: cateterização da artéria coronária esquerda nas incidências oblíqua anterior direita com angulação cranial e oblíqua anterior esquerda com angulação caudal (spider), evidenciando a ausência de lesões obstrutivas.
Foi então aumentado o INR alvo para 3‐4. Foi também repetido estudo analítico quatro meses após a alta hospitalar (24‐05‐2010), que matinha elevação de AAF e revelou anticorpos antinucleares (ANA) positivos.
O estudo de autoimunidade foi igualmente repetido após seis meses mostrando AAF fortemente positivos e ANA positivos. Foi repetida a RM CE (20‐12‐2010) que documentou a evolução das lesões de provável natureza vascular, com angio‐RM evidenciando repermeabilização dos ramos da ACMD previamente ocluídos.
O doente manteve‐se com clínica de insuficiência cardíaca em classe I da New York Heart Association sob terapêutica médica otimizada (varfarina para INR alvo 3‐4, sinvastatina 20mg id, perindopri 2mg id, nevibolol 2,5mg id, furosemida 40mg id, espironolactona 12,5mg id). A nova avaliação por ETT e ETE a 12 de janeiro de 2011 evidenciou redução das dimensões da massa da VM: 0,33x0,3cm (ETE), persistindo depressão moderada a grave da função sistólica do ventrículo esquerdo (fração de ejeção por Simpson biplano de 33%). Foi ainda repetido ETT a 23 de agosto de 2011, que documentou uma fração de ejeção sobreponível à verificada nos exames prévios, já sem visualização de massa na VM.
Perante estes resultados, o doente foi proposto para implantação de cardiodesfibrilhador implatável (CDI), que decorreu a 23 de setembro de 2011, sem complicações. Durante o seguimento posterior à implantação foram registadas terapias apropriadas do dispositivo (pacing antitaquicardia) por taquicardia ventricular, de acordo com a programação do dispositivo, sem que tenham resultado sintomas.
Após avaliação oftalmológica foi iniciada terapêutica crónica com hidroxicloroquina 400mg id em consulta de medicina interna. Manteve vigilância e correção dos fatores e risco cardiovascular, que incluíram a abstinência tabágica após o AVC e controlo da hipercolesterolemia com estatina, e profilaxia de endocardite bacteriana para procedimentos com risco de bacteriemia, e vigilância clínica, analítica e ecocardiográfica das manifestações de SS, SAF e LES.
DiscussãoO SS caracteriza‐se pela associação de lesões vasculares cerebrais, mais frequentemente no território da artéria cerebral média6–8, a LR, o qual geralmente precede a instalação do quadro neurológico, podendo fazê‐lo por várias décadas e intensificando‐se durante a fase aguda de uma complicação neurológica1 – tal como foi descrito neste caso clínico. O LR ocorre por diminuição do fluxo sanguíneo devido a oclusão arterial e vasoconstrição das vénulas da pele. Tem sido descrito como uma rede irregular de malhas largas, arborescente, de coloração cianótica ou violácea, pouco influenciado pela temperatura, que habitualmente começa por se localizar no tronco, de onde se pode estender progressivamente por zonas contíguas e só muito raramente afeta as extremidades – indicando, nestas condições, doença extensa1–3.
Neste caso clínico o diagnóstico de SS foi feito durante o episódio de AVC. O estudo subsequente permitiu reunir os critérios clínicos e laboratoriais necessários ao diagnóstico de SAF: AVC isquémico e AAF fortemente positivos em duas avaliações separadas em mais de 12 semanas. É reconhecido que doentes com SAF primário podem vir a reunir critérios de LES2. Têm também sido descritas na literatura séries de doentes que acabam por perfazer critérios de LES três a dez anos após o diagnóstico de SS5. No presente caso clínico, o doente apresentou alguns critérios de LES, tais como trombocitopenia <100x103/μL, ANA positivos e AAF positivos (AC anticardiolipina e anticoagulante lúpico). Contudo, o diagnóstico de LES implica a presença de quatro critérios, que poderiam considerar‐se presentes caso se considerasse a fotossensibilidade ou o fenómeno de artrite. No entanto, a descrição de fotossensibilidade foi pouco consistente ao longo do tempo e não foi verificada artrite apesar das artralgias referidas pelo doente. Dado que o SS associado a SAF também explicaria a trombocitopenia e os AAF, optou‐se por considerar o diagnóstico de SS associado a SAF e de dirigir o tratamento a estas entidades.
No presente caso foram verificados dois eventos isquémicos: AVC e enfarte do miocárdio (EM) evoluído, o segundo decorrido sob níveis terapêuticos de anticoagulação oral. Para além das lesões vasculares cerebrais e LR, o SS pode apresentar‐se com isquemia miocárdica e fibrose1–6, podendo explicar ambos os eventos. A ocorrência de eventos isquémicos recorrentes em territórios vasculares distintos, associada a depressão da função sistólica e a alterações segmentares da cinética do ventrículo esquerdo e a documentação de trombo na coronária direita, levantavam a possibilidade para uma etiologia trombótica ou embólica, que poderia ser explicada pelos seguintes mecanismos: 1) EM e AVC ocorrendo como dois epifenómenos trombóticos ou embólicos de SAF e/ou de SS, 2) depressão da função sistólica do ventrículo esquerdo por fenómenos trombóticos ou embólicos intracoronários condicionados por SS e/ou SAF, funcionando como fonte embólica cerebral, ou 3) massa da VM como fonte embólica coronária e cerebral.
No que respeita ao AVC, a sugestão imagiológica de sequelas de múltiplos AVC prévios pequenos e bilaterais e o atingimento do território da ACMD corresponde à localização tipicamente encontrada no SS. Sugere uma etiologia mantida ao longo do tempo, que poderia também corresponder a SAF ou massa da VM, sendo a oclusão da ACMD também típica de origem embólica. A repermeabilização sob hipocoagulação, documentada em angio‐RM, sugere tratar‐se de um trombo/coágulo, em detrimento de doença fibrótica local por SS ou embolização de massa da VM.
A descrição de um episódio de angor intenso sem recurso a cuidados de saúde, com remissão espontânea da dor, num doente hipocoagulado, e a posterior evidência de acinesia e fibrose transmural das paredes inferior e ínfero‐lateral, torna evidente a ocorrência de um enfarte prévio no território da artéria coronária direita, corroborado pelo resultado da coronariografia, com pequenas placas de aterosclerose e imagem sugestiva de trombo nessa artéria coronária. Possíveis etiologias para EM neste jovem poderiam ser aterosclerose acelerada por SAF ou LES, em associação fatores de risco cardiovascular como o tabagismo e a hipercolesterolemia, mas também uma embolização ou a um fenómeno trombótico local em contexto de SAF ou a embolização de massa da VM. Tendo em conta o contexto clínico e os achados angiográficos, considera‐se que a etiologia mais provável para o EM estaria relacionada com fenómenos trombóticos locais ou embólicos, que poderiam resultar do SS ou do SAF.
Os achados angiográficos foram desproporcionais à gravidade da disfunção ventricular esquerda, contudo, esta já estava presente no ETT inicial. A RM que documentou fibrose foi realizada quatro meses depois e a coronariografia cinco meses depois, encontrando‐se o doente já hipocoagualdo com INR terapêutico aquando da sua realização. Com efeito, a gravidade da disfunção ventricular na ausência de doença coronária epicárdica noutras artérias coronárias e associada a não recuperação de função ao longo do tempo sugerem que a embolização ou os fenómenos trombóticos locais nas coronárias possam ter sido previamente mais extensos.
A massa identificada na VM poderia corresponder a lesão fibrosa, que tem sido identificada no SS com localização preferencial na VM1–5, ou a vegetação não infeciosa, a qual se encontra descrita em 6‐10% dos doentes com SAF e em 11% dos doentes com LES14, também designada como endocardite de Libman‐Sacks. A regressão desta massa em simultâneo com hipocoagulação oral tem sido descrita nesta última etiologia, assim como a regressão espontânea14. No presente caso a massa poderá ainda ter diminuído devido a embolização, que por sua vez poderia originar de lesões vasculares cerebrais ou mesmo EM. As características de massa séssil, de ecogenecididade intermédia e heterogenea, bordos irregulares e bem definidos, mobilidade acompanhando o folheto posterior da VM, sugeriam uma vegetação não infeciosa, porém, a localização mais típica no LES ocorre na vertente ventricular da VM12, ao contrário do verificado neste caso. A massa poderia também corresponder a trombo na dependência da VM – uma possível apresentação de SAF6, embora menos frequente. A diminuição das suas dimensões sob hipocoagulação oral, a ecogenecidade heterogénea e intermédia e o sinal hipointenso em T2 estão de acordo com a hipótese de tombo. Já a presença de bordos bem definidos e a ausência de contraste espontâneo na aurícula/ventrículo esquerdos torna menos provável esta etiologia. Outra possível etiologia para a massa seria um tumor com características de benignidade – como um mixoma, o que seria compatível com o seu aspeto irregular, bem definido, heterogénea e de ecogenecidade intermédia, mas nesse caso tratar‐se‐ia de uma localização atípica e rara.
Apesar da avaliação clínica por três diferentes especialidades e da extensa avaliação diagnóstica, não foi possível esclarecer na totalidade os mecanismos acima propostos.
Na caracterização da massa, a RM não acrescentou significativamente informação à fornecida pelo ETE, tendo sido este o exame que melhor a permitiu caracterizar. No entanto, a RM identificou a presença de necrose, tendo sido útil para o diagnóstico de enfarte evoluído na sequência de episódio de dor torácica decorrida em meio extra‐hospitalar e num jovem.
No que respeita à terapêutica, nenhum tratamento efetivo é conhecido para o SS, contudo, anticoagulantes têm sido indicados no SS associado a SAF, enquanto no SS não associado a SAF os antiagregantes plaquetares constituem a estratégia terapêutica mais aceite7, em conjunto com controlo dos fatores de risco cardiovascular1–5. A correção destes fatores é, também, fundamental em doentes com SAF ou LES13–16.
No presente caso a hipocoagulação com varfarina seria a terapêutica inicial mais indicada pela possibilidade de eventos trombóticos em relação com SAF ou embólicos em relação com trombos ou com vegetação não infeciosa da VM. A corticoterapia não estaria indicada por ausência de critérios consistentes de LES ou, ainda assim, de lesão renal, neurolúpus, citopenia grave mantida ou hemorragia pulmonar. Por outro lado agravaria as lesões valvulares, o estado pró‐trombótico e a disfunção ventricular2,16. A elevação do INR alvo para 3‐4 e a hidroxicloroquina têm sido utilizados no SAF e LES para profilaxia em doentes com eventos trombóticos recorrentes14. A presença de anticorpos anticardiolipina >40U/mL e a associação de LES a estes autoanticorpos são reconhecidos preditores independentes de recorrência de eventos trombóticos a três anos em doentes com SAF10. A positividade do AC anti‐β2glicoproteína1 no evento trombótico inicial encurta o período de recorrência para <12 meses15. Todos estes fatores estavam presentes neste doente.
A excisão cirúrgica da massa não estaria indicada neste caso por ser de reduzidas dimensões e não condicionar disfunção valvular severa.
A profilaxia da endocardite bacteriana em procedimentos invasivos tem sido defendida nos doentes com vegetações valvulares não infeciosas15.
Face a um doente jovem com os diagnósticos de SS e SAF, com coronariografia sem evidência de doença coronária aterosclerótica epicárdica, mas documentando um trombo na artéria coronária direita com bom fluxo distal ao mesmo, com documentação prévia de ausência de viabilidade no território da artéria coronária direita por RM, em que a etiologia trombótica ou embólica foi considerada muitíssimo provável e encontrando‐se o doente já hipocoagulado, os autores consideraram que a realização de um teste de isquemia ou viabilidade não alteraria o tratamento do doente.
Neste caso a indicação para CDI foi proposta como prevenção primária de morte súbita em jovem com cardiopatia isquémica, com fibrose transmural comprovada por RM cardíaca e fração de ejeção do ventrículo esquerdo <40%, mantida em avaliações com realizadas após quatro, 12 e 20 meses, em classe I da New York Heart Association sob terapêutica médica otimizada, tendo a sua utilidade sido demonstrada por episódios de taquicardia ventricular interrompidos por pacing antitaquicardia, que na ausência destas terapias poderiam ter sido fatais.
ConclusãoOs autores apresentam um caso raro de SS associado a SAF e possivelmente a LES, que reuniu duas formas diferentes de apresentação cardíaca: massa valvular e EM extenso em jovem. Salienta‐se que perante um enfarte em idade jovem deve ser considerada a possibilidade de doenças sistémicas, tais como SAF, LES ou SS. Realça‐se o carácter interdisciplinar, a complexidade e a dificuldade na abordagem de manifestações cardiovasculares de doenças sistémicas.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Política de privacidade, consentimento informado, proteção de dados e dos doentesO doente foi devidamente informado e forneceu um consentimento informado escrito para a publicação do caso clínico. A identificação do doente não foi, em nenhum momento deste trabalho, revelada.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Os autores agradecem ao Serviço de Radiologia e Neurorradiologia pelo seu contributo para este caso clínico e pelas imagens disponibilizadas.