A hemorragia major (HM) é uma complicação grave da síndrome coronária aguda (SCA) e está associada a pior prognóstico. O score CRUSADE permite estratificar o risco de HM na SCA.
ObjetivoAvaliar a capacidade preditiva do score CRUSADE numa população contemporânea de SCA.
MétodosEstudo unicêntrico e retrospetivo com 2818 doentes admitidos por SCA. O score CRUSADE foi calculado para cada doente, a sua discriminação e calibração foram avaliadas pela área abaixo da curva (AUC) Receiver Operating Characteristic e pelo teste Hosmer‐Lemeshow, respetivamente. Foram determinados os preditores de HM intra‐hospitalar (HMIH).
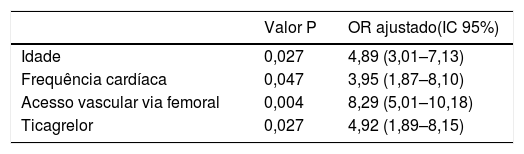
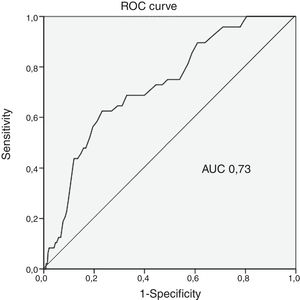
ResultadosA taxa de HMIH foi de 1,8%, valor significativamente inferior ao estimado pelo score CRUSADE (7,1%, p <0,001). A incidência de HMIH nas diferentes categorias foi de 0,5% na de muito baixo risco (taxa estimada pelo score de 3,1%); 1,5% na de baixo (estimada de 5,5%); 1,6% na de moderado (estimada de 8,6%); 5,5% na de elevado (estimada de 11,9%) e 4,4% na de muito elevado (estimada de 19,5%). A capacidade preditora do score CRUSADE para HMIH foi apenas moderada (AUC 0,73). A taxa de mortalidade intra‐hospitalar foi de 4,0%. A idade mais avançada (p=0,027), o acesso vascular femoral (p=0,004), a frequência cardíaca mais elevada (p=0,047) e o ticagrelor (p=0,027) foram preditores independentes de HMIH.
ConclusãoO score CRUSADE, apesar de apresentar algum poder discriminatório, sobrestimou de forma significativa a taxa de HMIH, principalmente nos doentes de maior risco. Esses resultados questionam se o score CRUSADE deverá continuar a ser usado na estratificação da SCA.
Major bleeding is a serious complication of acute coronary syndrome (ACS) and is associated with a worse prognosis. The CRUSADE bleeding score is used to stratify the risk of major bleeding in ACS.
ObjectiveTo assess the predictive ability of the CRUSADE score in a contemporary ACS population.
MethodsIn a single‐center retrospective study of 2818 patients admitted with ACS, the CRUSADE score was calculated for each patient and its discrimination and goodness of fit were assessed by the area under the receiver operating characteristic curve (AUC) and by the Hosmer‐Lemeshow test, respectively. Predictors of in‐hospital major bleeding (IHMB) were determined.
ResultsThe IHMB rate was 1.8%, significantly lower than predicted by the CRUSADE score (7.1%, p<0.001). The incidence of IHMB was 0.5% in the very low risk category (rate predicted by the score 3.1%), 1.5% in the low risk category (5.5%), 1.6% in the moderate risk category (8.6%), 5.5% in the high risk category (11.9%), and 4.4% in the very high risk category (19.5%). The predictive ability of the CRUSADE score for IHMB was only moderate (AUC 0.73).
The in‐hospital mortality rate was 4.0%. Advanced age (p=0.027), femoral vascular access (p=0.004), higher heart rate (p=0.047) and ticagrelor use (p=0.027) were independent predictors of IHMB.
ConclusionsThe CRUSADE score, although presenting some discriminatory power, significantly overestimated the IHMB rate, especially in patients at higher risk. These results question whether the CRUSADE score should continue to be used in the stratification of ACS.
Ácido acetilsalicílico
Acidente vascular cerebral
A Comparison of Prasugrel at the Time of Percutaneous Coronary Intervention Or as Pre‐treatment at the Time of Diagnosis in Patients With Non‐ST‐Elevation Myocardial Infarction
Área abaixo da curva
Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the ACC/AHA guidelines
Cirurgia de revascularização miocárdica
Doença pulmonar obstrutiva crónica
Doença renal crónica
Enfarte agudo do miocárdio
Fração de ejeção ventricular esquerda
Glicoproteína
Global Registry of Acute Coronary Events
Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries
Hemorragia major
Hemorragia major intra‐hospitalar
Hipertensão arterial
Hosmer‐Lemeshow
Intervalo de confiança
Intervenção coronária percutânea
Minimizing Adverse Haemorrhagic Events by TRansradial Access Site and Systemic Implementation of angioX
Mortalidade intra‐hospitalar
Odds ratio
Organization for the Assessment of Strategies for Ischemic Syndromes
Radial Versus Femoral Access for Coronary intervention
Receiver Operatic Characteristic
Síndrome coronária aguda
The Harmonizing Outcomes with RevasculariZatiON and Stents in Acute Myocardial Infarction
Os doentes com síndrome coronária aguda (SCA) representam uma população heterogénea com diferentes riscos de eventos pelo que a avaliação inicial tem um papel principal na definição da estratégia terapêutica mais adequada1. O tratamento desses doentes engloba terapêutica antitrombótica e procedimentos invasivos que condicionam risco acrescido de hemorragia2, cuja incidência varia entre 1‐10%3. A variabilidade da incidência das complicações hemorrágicas é secundária a vários fatores, incluindo diferenças nas características dos doentes, terapêuticas concomitantes e diferentes definições de hemorragia usadas3. No entanto, independentemente da definição usada, vários estudos demonstraram que os eventos hemorrágicos estão associados a eventos adversos, tais como morte, enfarte agudo do miocárdio (EAM) não fatal, acidente vascular cerebral (AVC) e trombose de stent3–5.
A avaliação do risco hemorrágico inclui história detalhada de sintomas hemorrágicos, comorbilidades predisponentes, avaliação de dados analíticos e o uso de um score de risco hemorrágico6.
O score CRUSADE7 foi desenvolvido numa população abrangente de doentes com SCA sem elevação de ST para avaliar o risco hemorrágico e, mais recentemente, foi também validado no EAM com elevação de ST8. Esse score contempla oito variáveis que incluem características basais, variáveis clínicas e valores laboratoriais na admissão7. Atualmente, é o método mais usado para determinar o risco hemorrágico por ter demonstrado melhor poder discriminatório6,9,10.
O uso do score CRUSADE tem como objetivo estratificar os doentes com SCA, permite escolher estratégias terapêuticas mais adequadas de modo a reduzir o risco de hemorragia e consequentemente melhorar o prognóstico9.
Com este estudo, os autores pretendem analisar a aplicabilidade do score CRUSADE nos doentes com SCA, considerando que nos últimos 10 anos se verificaram modificações importantes na abordagem e no tratamento desses doentes.
MétodosDesenho do estudoEstudo retrospetivo, descritivo e correlacional do Centro Hospitalar Universitário do Algarve com doentes admitidos com o diagnóstico de SCA no serviço de Cardiologia de 1 de outubro de 2010 a 31 de agosto de 2014. O score CRUSADE foi calculado para cada doente e foi avaliada a capacidade de predição de hemorragia major intra‐hospitalar (HMIH). Foram avaliados os preditores de HMIH.
Seleção de doentesForam incluídos 2818 doentes com o diagnóstico de síndrome coronária aguda com evolução inferior a 48h. O diagnóstico de EAM foi definido como a presença de dor torácica ou equivalente anginoso nas últimas 48h associada a alterações eletrocardiográficas isquémicas (desvios do segmento ST ou ondas T negativas) e elevação de troponina acima do valor de referência. O diagnóstico de angina instável foi definido pela presença de dor torácica ou equivalente anginoso associada ou não a alterações eletrocardiográficas isquémicas na ausência de elevação de troponina acima do valor de referência.
Foram excluídos os doentes com EAM após procedimentos de revascularização (EAM tipo 4 e 5) e com EAM tipo 2 (classificação de acordo com a redefinição de Enfarte do Miocárdio de 2007da Joint ESC/ACCF/AHA/WHF Task Force)11.
Na análise da capacidade preditiva do score CRUSADE, dos 2818 doentes foram excluídos 203 (7,2%) devido à impossibilidade de calcular o respetivo score.
Colheita de dadosForam colhidos dados demográficos (idade e género), antecedentes pessoais relevantes (antecedentes de EAM, insuficiência cardíaca, intervenção coronária percutânea [ICP], cirurgia de revascularização miocárdica, hemorragia, angina de peito, doença pulmonar obstrutiva crónica [DPOC] e neoplasia), fatores de risco cardiovascular (hipertensão arterial [HTA], diabetes, dislipidemia e tabagismo atual). Foram avaliados dados relacionados com o internamento, nomeadamente dados clínicos na admissão (pressão arterial sistólica, frequência cardíaca e hematócrito), dados da coronariografia (acesso vascular e feitura de angioplastia), fração de ejeção ventricular esquerda, tipo de SCA (EAM com elevação do segmento ST, EAM sem elevação do segmento ST, EAM de localização indeterminada e angina instável), medicação administrada (ácido acetilsalicílico [AAS], clopidogrel, ticagrelor, enoxaparina, heparina não fracionada, fondaparinux, varfarina, inibidor das glicoproteínas IIb/IIIa.
A clearance de creatinina foi estimada com a fórmula de Cockcroft‐Gault.12
A doença vascular foi definida por antecedentes de doença arterial periférica e/ou acidente vascular cerebral.
Mortalidade intra‐hospitalar (MIH) foi definida como morte de qualquer causa ocorrida durante o internamento por SCA.
Endpoint do estudoOs endpoints deste estudo correspondem à avaliação da capacidade preditiva do score CRUSADE de HMIH e à determinação dos preditores independentes de HMIH.
A hemorragia major intra‐hospitalar (HMIH) foi definida segundo a classificação de GUSTO como a ocorrência de hemorragia intracraniana ou hemorragia com compromisso hemodinâmico requerendo intervenção13. O score CRUSADE foi calculado para cada doente através das oito variáveis (hematócrito basal, taxa de filtração glomerular, frequência cardíaca na admissão, pressão arterial sistólica na admissão, sinais de insuficiência cardíaca na admissão, género, história de doença vascular e diabetes mellitus). Foram estabelecidas cinco categorias de risco de hemorragia grave durante o internamento segundo os pontos de corte e intervalos definidos pelos investigadores do CRUSADE7, designadamente muito baixo risco (pontuação inferior a 20), baixo (21 a 30 pontos), moderado (31 a 40 pontos), elevado (41 a 50 pontos) e muito elevado (superior a 50).
Análise estatísticaFoi efetuada análise descritiva para a caracterização do perfil amostral. As variáveis contínuas são apresentadas como média e desvio padrão. As variáveis categóricas são apresentadas em número (percentagem). Para cada doente foi calculado o score CRUSADE.
A capacidade preditiva do score CRUSADE na nossa população foi testada por análise da área abaixo da curva (AUC) Receiver Operating Characteristic (ROC)14 e a calibração do modelo pelo teste de Hosmer‐Lemeshow (H‐L)15. Com o teste H‐L, um modelo terá uma calibração adequada se o valor de p não for significativo.
Para averiguação da existência de associação entre variáveis de natureza categórica aplicou‐se o teste de qui‐quadrado, na presença de uma variável contínua aplicou‐se o teste t de Student.
Para aferição de preditores de hemorragia major intra‐hospitalar aplicou‐se uma regressão logística binária. Considerou‐se como nível de significância de 95% com um valor p inferior a 0,05. A análise estatística foi feita com o software IBM SPSS Statistics (version 20.0).
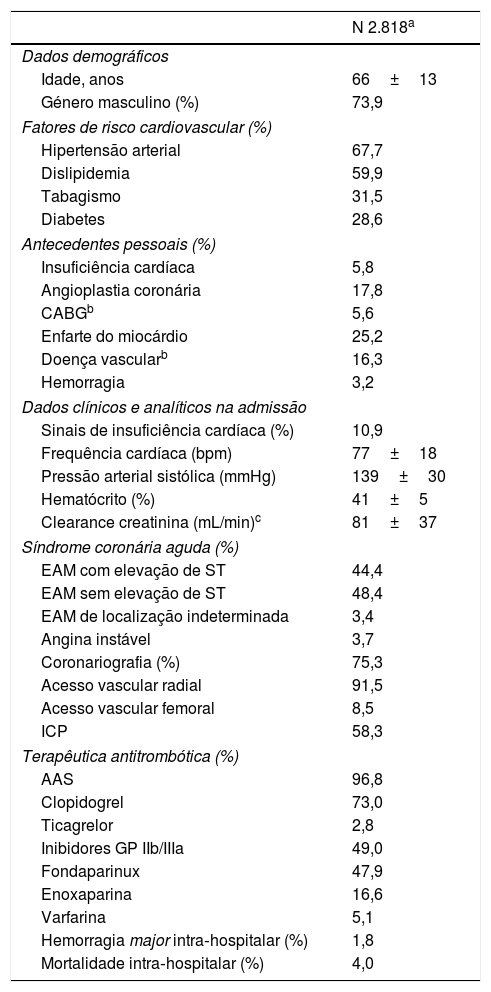
ResultadosCaracterísticas da populaçãoAs características basais da população do estudo estão apresentadas na Tabela 1.
Características clínicas da população
| N 2.818a | |
|---|---|
| Dados demográficos | |
| Idade, anos | 66±13 |
| Género masculino (%) | 73,9 |
| Fatores de risco cardiovascular (%) | |
| Hipertensão arterial | 67,7 |
| Dislipidemia | 59,9 |
| Tabagismo | 31,5 |
| Diabetes | 28,6 |
| Antecedentes pessoais (%) | |
| Insuficiência cardíaca | 5,8 |
| Angioplastia coronária | 17,8 |
| CABGb | 5,6 |
| Enfarte do miocárdio | 25,2 |
| Doença vascularb | 16,3 |
| Hemorragia | 3,2 |
| Dados clínicos e analíticos na admissão | |
| Sinais de insuficiência cardíaca (%) | 10,9 |
| Frequência cardíaca (bpm) | 77±18 |
| Pressão arterial sistólica (mmHg) | 139±30 |
| Hematócrito (%) | 41±5 |
| Clearance creatinina (mL/min)c | 81±37 |
| Síndrome coronária aguda (%) | |
| EAM com elevação de ST | 44,4 |
| EAM sem elevação de ST | 48,4 |
| EAM de localização indeterminada | 3,4 |
| Angina instável | 3,7 |
| Coronariografia (%) | 75,3 |
| Acesso vascular radial | 91,5 |
| Acesso vascular femoral | 8,5 |
| ICP | 58,3 |
| Terapêutica antitrombótica (%) | |
| AAS | 96,8 |
| Clopidogrel | 73,0 |
| Ticagrelor | 2,8 |
| Inibidores GP IIb/IIIa | 49,0 |
| Fondaparinux | 47,9 |
| Enoxaparina | 16,6 |
| Varfarina | 5,1 |
| Hemorragia major intra‐hospitalar (%) | 1,8 |
| Mortalidade intra‐hospitalar (%) | 4,0 |
AAS: ácido acetilsalicílico; CABG: cirurgia de revascularização miocárdica; EAM: enfarte agudo do miocárdio; GP: glicoproteínas; ICP: intervenção coronária percutânea
Foram incluídos 2818 doentes com SCA, 73,9% do género masculino, com idade média de 66 ± 13 anos. Na admissão hospitalar, os doentes tinham um hematócrito médio de 41±5%, frequência cardíaca média de 77±18 bpm, pressão arterial sistólica média de 139±30mmHg, taxa de filtração glomerular média de 81±37ml/min e 10,9% apresentavam sinais de insuficiência cardíaca. O diagnóstico de admissão mais frequente foi o EAM sem elevação de ST (48,4%), seguido do EAM com elevação de ST (44,4%). Foi feita coronariografia em 75,3% dos doentes, 91,5% através de acesso vascular radial e 58,3% foram submetidos a angioplastia coronária. Relativamente à terapêutica antitrombótica no internamento, 96,8% dos doentes receberam aspirina, 73% clopidogrel, 2,8% ticagrelor e 47,9% fondaparinux.
Durante o internamento, 113 (4,0%) doentes faleceram e 52 (1,8%) apresentaram HMIH.
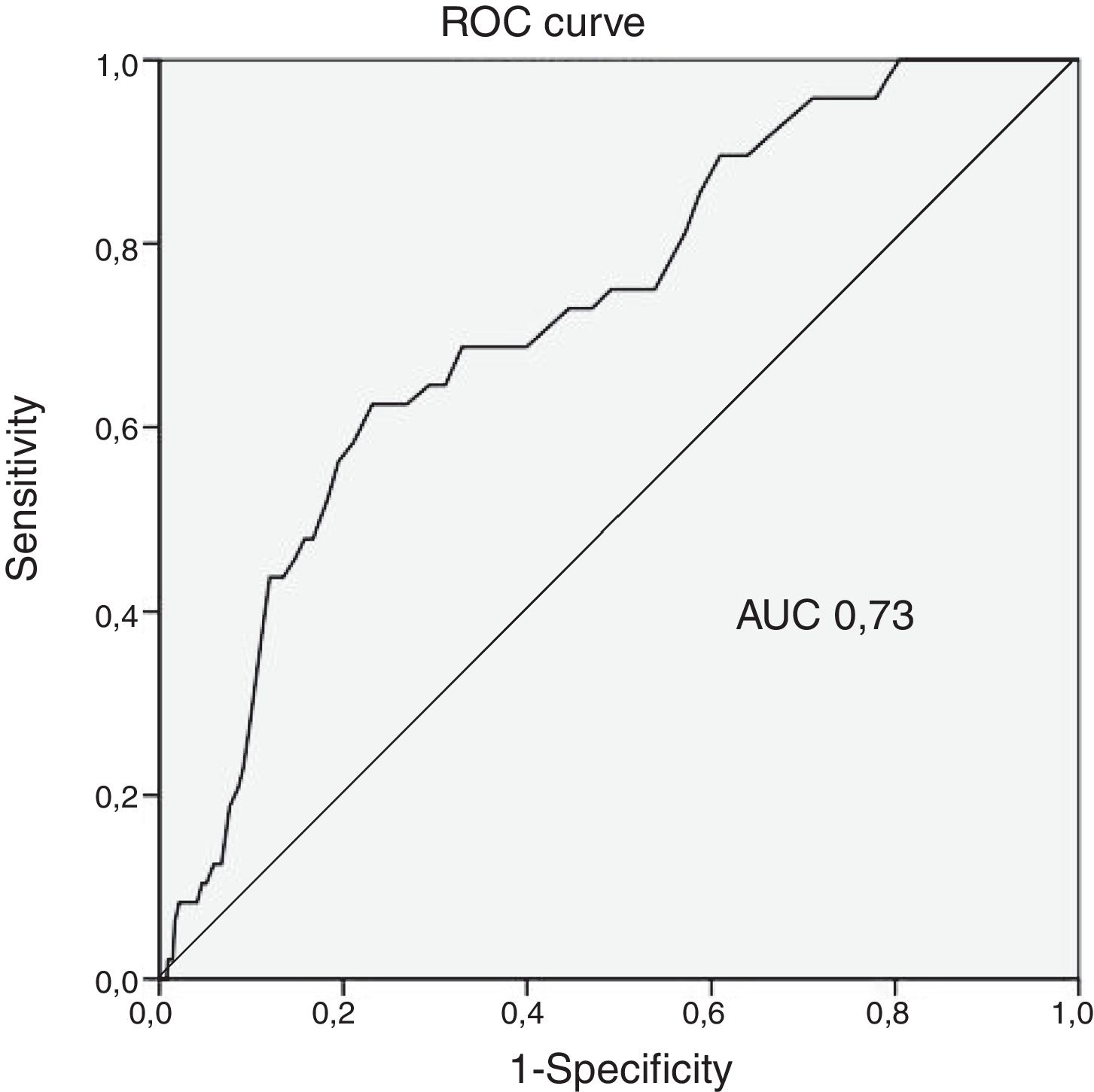
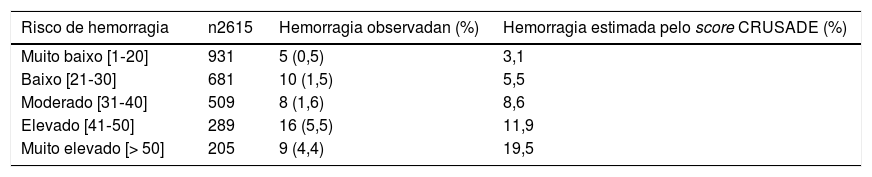
Poder discriminatório do score CRUSADEA hemorragia estimada pelo score CRUSADE para a nossa população foi de 7,1%, valor estatisticamente diferente do que obtivemos (p<0,001) (Tabela 2). A incidência de HMIH nas diferentes categorias do score CRUSADE foi de 0,5% na de muito baixo risco (taxa estimada pelo score de 3,1%); 1,5% na de baixo (estimada de 5,5%); 1,6% na de moderado (estimada de 8,6%); 5,5% na de elevado (estimada de 11,9%) e 4,4% na de muito elevado (estimada de 19,5%) (Tabela 3). A capacidade preditiva do score CRUSADE na nossa população foi moderada, com uma área abaixo da curva ROC de 0,73 (Figura 1).
Hemorragia observada na nossa coorte versus hemorragia estimada pelo score CRUSADE
| Risco de hemorragia | n2615 | Hemorragia observadan (%) | Hemorragia estimada pelo score CRUSADE (%) |
|---|---|---|---|
| Muito baixo [1‐20] | 931 | 5 (0,5) | 3,1 |
| Baixo [21‐30] | 681 | 10 (1,5) | 5,5 |
| Moderado [31‐40] | 509 | 8 (1,6) | 8,6 |
| Elevado [41‐50] | 289 | 16 (5,5) | 11,9 |
| Muito elevado [> 50] | 205 | 9 (4,4) | 19,5 |
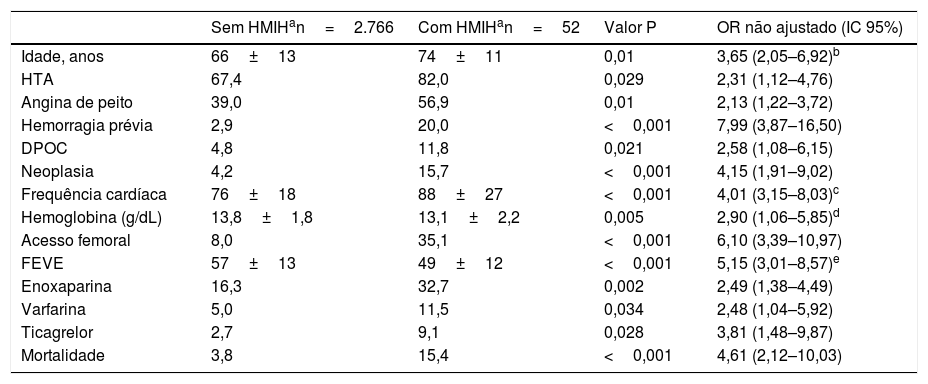
O endpoint HMIH associou‐se às seguintes variáveis: idade mais avançada (p=0,01), HTA (p=0,029), angina de peito (p=0,01), hemorragia prévia (p <0,001), DPOC (p=0,021), neoplasia (p <0,001), frequência cardíaca mais elevada na admissão (p <0,001), menor valor de hemoglobina (p=0,005), acesso vascular femoral (p <0,001) e menor fração de ejeção ventricular esquerda (FEVE) na alta hospitalar (p <0,001). A HMIH associou‐se a maior mortalidade intra‐hospitalar (15,4% versus 3,8%; p <0,001) (Tabela 4).
Variáveis que se associaram a hemorragia major intra‐hospitalar
| Sem HMIHan=2.766 | Com HMIHan=52 | Valor P | OR não ajustado (IC 95%) | |
|---|---|---|---|---|
| Idade, anos | 66±13 | 74±11 | 0,01 | 3,65 (2,05–6,92)b |
| HTA | 67,4 | 82,0 | 0,029 | 2,31 (1,12–4,76) |
| Angina de peito | 39,0 | 56,9 | 0,01 | 2,13 (1,22–3,72) |
| Hemorragia prévia | 2,9 | 20,0 | <0,001 | 7,99 (3,87–16,50) |
| DPOC | 4,8 | 11,8 | 0,021 | 2,58 (1,08–6,15) |
| Neoplasia | 4,2 | 15,7 | <0,001 | 4,15 (1,91–9,02) |
| Frequência cardíaca | 76±18 | 88±27 | <0,001 | 4,01 (3,15–8,03)c |
| Hemoglobina (g/dL) | 13,8±1,8 | 13,1±2,2 | 0,005 | 2,90 (1,06–5,85)d |
| Acesso femoral | 8,0 | 35,1 | <0,001 | 6,10 (3,39–10,97) |
| FEVE | 57±13 | 49±12 | <0,001 | 5,15 (3,01–8,57)e |
| Enoxaparina | 16,3 | 32,7 | 0,002 | 2,49 (1,38–4,49) |
| Varfarina | 5,0 | 11,5 | 0,034 | 2,48 (1,04–5,92) |
| Ticagrelor | 2,7 | 9,1 | 0,028 | 3,81 (1,48–9,87) |
| Mortalidade | 3,8 | 15,4 | <0,001 | 4,61 (2,12–10,03) |
DPOC: Doença pulmonar obstrutiva crónica; FEVE: fração de ejeção ventricular esquerda; HMIH: hemorragia major intra‐hospitalar; HTA: hipertensão arterial; IC: intervalo de confiança; OR: odds ratio.
Quando incluídas em análise multivariada todas as associações significativas previamente referidas, a idade mais avançada (p=0,027), o acesso vascular femoral (p=0,004), a frequência cardíaca mais elevada (p=0,047) e a toma de ticagrelor durante o internamento (p=0,027) foram preditores de HMIH (Tabela 5).
DiscussãoNa nossa população contemporânea de doentes com SCA, o score CRUSADE sobrestimou o risco de hemorragia major intra‐hospitalar.
Hemorragia major intra‐hospitalarNo nosso estudo, a taxa de HMIH foi de 1,8%. Na literatura, a incidência de HMIH varia entre 1‐10%, cuja variabilidade é secundária a vários fatores, como são exemplo diferenças nas características dos doentes, terapêuticas concomitantes e diferentes definições de hemorragia usadas3.
A taxa de HMIH obtida foi significativamente inferior à esperado pelo score CRUSADE (7,1%) para a nossa população (p <0,001). Quando comparadas as várias categorias de risco, verificou‐se que o score CRUSADE sobrestimou a taxa de HMIH em todas as categorias. Observaram‐se maiores diferenças nas categorias de risco mais elevadas (risco moderado, elevado e muito elevado). Esses resultados podem ser explicados pela evidência de que a taxa de HMIH nos doentes com SCA tem reduzido ao longo do tempo, apesar do uso de terapêuticas farmacológicas e de intervenção mais agressivas. Fox et al., entre 2000 e 2007, reportaram uma redução significativa nas taxas de hemorragia de 2,6% para 1,8% nos doentes com SCA (p <0,001)16. Vários fatores poderão ter contribuído para esses resultados, como são exemplo a melhoria da técnica da cateterização cardíaca, o uso de cateteres de menor calibre, o uso do acesso vascular radial, melhor seleção da terapêutica antitrombótica ou alteração do limiar para transfusão de concentrado eritrocitário16. É reconhecido que os doentes com HMIH apresentam pior prognóstico, com maior risco de mortalidade intra‐hospitalar16,17. No estudo de Spencer et al., com 40 087 doentes com SCA, a HMIH associou‐se a maior mortalidade intra‐hospitalar (21% versus 6%, p <0,001)17. No nosso estudo, a HMIH também se associou a maior mortalidade (15,4% versus 3,8%, p <0,001). A HMIH tem um impacto negativo no prognóstico dos doentes com SCA, é necessário implantar estratégias para a sua redução. Não obstante, vários preditores de hemorragia são também preditores de eventos isquêmicos, o que dificulta a obtenção da máxima eficácia anti‐isquémica com mínimo risco hemorrágico7,10.
Poder discriminatório do score CRUSADENa nossa população, a capacidade preditora do score CRUSADE para HMIH foi aceitável, com uma área abaixo da curva ROC de 0,73. No entanto, esse resultado não é ótimo. Abu‐Assi et al. avaliaram a performance do score CRUSADE numa coorte de 4500 doentes com SCA e objetivaram um poder discriminatório de 0,80 na predição de hemorragia major9. Similarmente, Manzano‐Fernández et al. em 1587 doentes com SCA relataram um poder discriminatório de 0,791. Contrariamente, outras séries reportaram um pior poder discriminatório. Ariza‐Solé et al., em 1976 doentes com SCA, determinaram um poder discriminatório de 0,7018. Amador et al., em 516 doentes com SCA sem elevação de ST, objetivaram uma AUC de 0,6119. Em determinados subgrupos de populações, como são exemplo os doentes com idade superior a 75 anos, os que não fizeram coronariografia e os anticoagulados previamente, foi demonstrado que o score CRUSADE tem uma capacidade preditiva muito modesta com AUC inferiores a 0,709,20,21. Na verdade, relativamente aos doentes sob estratégia conservadora, o desempenho do CRUSADE foi modesto na população na qual foi desenvolvido o score, com uma AUC de 0,687. Desse modo, verifica‐se uma importante heterogeneidade no poder discriminatório do score CRUSADE nos doentes com SCA. Vários fatores podem contribuir para essas diferenças e dificultar a avaliação do risco hemorrágico, como são exemplo a idade, as comorbilidades, a terapêutica antitrombótica instituída, a estratégia escolhida (invasiva ou conservadora) ou o acesso vascular da coronariografia. É necessário desenvolver um score adequado à prática clínica atual que permita a correta, personalizada e acessível estratificação dos doentes com SCA.
Preditores de hemorragia major intra‐hospitalarNo nosso estudo determinámos como preditores independentes de HMIH a idade mais avançada, a frequência cardíaca mais elevada na admissão, o acesso vascular via femoral e a toma de ticagrelor durante o internamento.
Como referido previamente, os doentes com SCA são heterogéneos o que condiciona a determinação de diferentes preditores em diferentes populações de doentes. O estudo de Mehran et al. com 17421 doentes com SCA determinou sete preditores de hemorragia, nomeadamente género feminino, idade avançada, creatinina sérica elevada, contagem de leucócitos, anemia e uso de heparina não fracionada com inibidor GP IIb/IIIa22. Moscucci et al., no registo GRACE com 24.045 doentes com SCA, identificaram como preditores género feminino, idade avançada, insuficiência renal e história prévia de hemorragia23. Nikolsky et al., além da idade, do género feminino e da insuficiência renal, determinaram a anemia pré‐existente, administração de heparina de baixo peso molecular nas 48h antes da ICP e o uso de balão intra‐aórtico como preditores de hemorragia24. Apesar de as diferenças na incidência e na definição de hemorragia entre os estudos, a idade, o género feminino e a insuficiência renal são variáveis frequentemente identificadas2,22,23. No nosso estudo, o ticagrelor foi preditor de HMIH. Esse resultado tem de ser interpretado no contexto de que apenas 2,8% dos doentes tomaram esse fármaco. No estudo PLATO25, a toma de ticagrelor demonstrou reduzir a mortalidade cerebrovascular e cardiovascular, o EAM e o AVC, mas associou‐se a maior taxa de hemorragia major não relacionada com cirurgia de revascularização miocárdica comparativamente ao clopidogrel (4,5% versus 3,8%; p=0,03) 25.
Acesso vascular da coronariografiaNo nosso estudo, 91,5% dos doentes fizeram coronariografia por acesso vascular radial, valor que é superior a outras séries publicadas que avaliaram a aplicabilidade do CRUSADE e que reportaram taxas entre 64‐83,1%1,9,18,26. Na análise multivariada, o acesso vascular femoral foi preditor independente de HMIH (p=0,004), resultado que está de acordo com a evidência clínica mais recente27,28. No entanto, importa salientar que esse resultado tem de ser interpretado no contexto de que apenas 8,5% dos doentes fizeram coronariografia por acesso vascular femoral. Nos doentes submetidos a ICP, a hemorragia major periprocedimento é uma complicação possível com incidência de 1,7‐3,5% nas séries mais contemporâneas29–31. Várias séries mostraram que o acesso vascular radial está associado a menor taxa de complicações hemorrágicas periprocedimento comparativamente ao acesso femoral32–35. O estudo RIVAL reportou redução das complicações vasculares major nos doentes com SCA com o uso do acesso radial (1,4% versus 3,7%; p <0,0001)35. No entanto, relativamente à mortalidade os resultados não foram consistentes, tendo‐se verificado redução dela nos doentes com EAM com elevação de ST, mas não nos doentes com SCA sem elevação de ST35. Mais recentemente, o estudo MATRIX mostrou que o uso do acesso radial reduziu a taxa de complicações hemorrágicas e a mortalidade global dos doentes com SCA (EAM com elevação de ST e no EAM sem elevação de ST) comparativamente ao acesso femoral27. Nesse contexto, as guidelines europeias recomendam o uso do acesso vascular radial com classe de recomendação I, nível de evidência A10.
No nosso estudo, a elevada taxa de uso de acesso vascular radial poderá ter contribuído para uma menor taxa de HMIH observada na nossa população. A não inclusão do tipo de acesso vascular é uma limitação do score CRUSADE.
FondaparinuxRelativamente à anticoagulação, em 47,9% dos doentes foi usado fondaparinux, valor bastante superior ao uso de enoxaparina (16,6%). No estudo OASIS‐5, nos doentes com SCA sem elevação de ST, o fondaparinux demonstrou reduzir significativamente os eventos hemorrágicos major comparativamente à enoxaparina (p <0,001)36. Nesse contexto, o fondaparinux é o anticoagulante parentérico recomendado nos doentes com SCA sem elevação de ST por apresentar o melhor perfil segurança/eficácia10. Apesar de as recomendações atuais, outras séries reportam taxas mais baixas de uso do fondaparinux (1,6‐14%)1,9,37. Consideramos que o uso desse anticoagulante parentérico nos nossos doentes também pode ter contribuído para uma menor taxa de hemorragia major.
Inibidores de glicoproteínas IIb/IIIa e inibidores dos recetores P2Y12Quanto ao uso de inibidores de IGP IIb/IIIa, em 49% dos nossos doentes foi administrado esse fármaco, valor comparativamente superior a outras séries publicadas (5,7‐40,2%)1,9,18,19,37. Salienta‐se que na maioria dos nossos doentes apenas foi administrado bólus de eptifibatide durante a coronariografia, sem a perfusão do fármaco após angioplastia, facto que poderá ter contribuído para a reduzida taxa de complicações hemorrágicas periprocedimento. A evidência científica demonstrou que nos doentes com SCA sem elevação de ST submetidos a ICP o uso de IGP conduziu à redução de eventos isquémicos, principalmente através da redução reenfarte, embora com aumento da taxa de hemorragia6,38. O estudo HORIZONS‐AMI, ao demonstrar superioridade da bivalirudina sobre a heparina combinada com IGP IIb/IIIa nos doentes submetidos a ICP primária, com a redução significativa da taxa de hemorragia e redução da mortalidade a 30 dias, conduziu à diminuição do uso dos IGP IIb/IIIa39. Atualmente, as guidelines europeias apenas contemplam o uso dos IGP IIb/IIIa na SCA para situações de bailout ou na presença de complicações trombóticas (IIa,C)10,40. Contrariamente, as guidelines americanas defendem que em doentes com SCA sem elevação de ST de elevado risco e não adequadamente pré‐tratados com ticagrelor ou clopidogrel a administração de um IGP IIb/IIIa no momento da ICP é útil (I,A). Ainda no grupo de doentes com SCA sem elevação de ST de elevado risco, naqueles que foram tratados com heparina não fracionada e pré‐tratados adequadamente com clopidogrel ou ticagrelor, é razoável administrar IGP (IIa,B)6. Realça‐se que os nossos doentes fizeram preferencialmente um inibidor do recetor P2Y12 durante ou após a angioplastia, dado que também poderá ter contribuído para uma menor taxa de hemorragia major. Segundo as guidelines atuais, os doentes com SCA devem receber pré‐tratamento com um inibidor P2Y126,10,40. Contudo, no caso do SCA sem elevação de ST, a evidência científica recente tem questionado o pré‐tratamento41,42, como é exemplo o estudo ACCOAST42, que demonstrou que o pré‐tratamento com prasugrel não reduziu a taxa de eventos isquémicos e conduziu ao aumento da taxa de complicações hemorrágicas.
Implicações clínicasÉ reconhecido que a terapêutica antitrombótica, peça fundamental no tratamento anti‐isquémico da SCA, condiciona um maior risco hemorrágico. Os doentes com SCA constituem uma população muito heterogénea e consequentemente, para uma prescrição judiciosa, é necessário estratificar o seu risco isquémico e hemorrágico de modo a obter a mesma eficácia com redução dos efeitos indesejados31. No entanto, na última década, verificaram‐se modificações importantes na abordagem e na estratégia terapêutica dos doentes com SCA. Essas alterações podem ter modificado o valor preditivo dos scores de risco10. Desse modo, torna‐se premente desenvolver ferramentas para estratificar o risco hemorrágico com o objetivo de privilegiar estratégias que reduzam a taxa de hemorragia e consequentemente melhorem o prognóstico desses doentes9.
LimitaçõesTrata‐se de um estudo retrospetivo, observacional, unicêntrico e por esses motivos está sujeito a viés inerente. A baixa taxa de eventos hemorrágicos pode influenciar os resultados e, nesse contexto, devem ser validados numa maior coorte de doentes. O uso de diferentes classificações de hemorragia major é outra limitação do nosso estudo. No estudo CRUSADE, a hemorragia major foi definida por hemorragia intracraniana, retroperitoneal, descida de hematócrito ≥ 12% relativamente ao valor basal, transfusão de concentrado eritrocitário quando o hematócrito basal era ≥ 28% ou transfusão de concentrado eritrocitário quando o hematócrito basal era <28% com hemorragia presenciada. No nosso trabalho foi usada a classificação de GUSTO, que define hemorragia major como a ocorrência de hemorragia intracraniana ou hemorragia com compromisso hemodinâmico que requer intervenção13.
ConclusãoNo nosso estudo, a taxa de hemorragia major intra‐hospitalar foi de 1,8%. O score CRUSADE, apesar de apresentar algum poder discriminatório, sobrestimou de forma significativa a taxa de ocorrência de hemorragia, principalmente no grupo de doentes com score mais elevado. Os resultados deste estudo questionam se o score CRUSADE deverá continuar a ser considerado na estratificação do risco hemorrágico na SCA e consequentemente serem implantadas medidas específicas de acordo com o seu resultado.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.



 ROC) do score
ROC) do score 

