O pseudoaneurisma da via de saída do ventrículo esquerdo (VSVE) é uma patologia rara decorrente de agressões sofridas pelo ventrículo esquerdo, como infarto agudo do miocárdio, endocardite infecciosa ou trauma cirúrgico, sendo uma afeção de alta morbimortalidade. Descreve-se um caso de pseudoaneurisma de VSVE gigante ainda mais raramente relatado na literatura. A lesão foi detetada 12 anos após a troca da válvula aórtica por endocardite infecciosa, num paciente jovem e ex-toxicodependente. Por ser uma patologia incomum, pouco se sabe sobre a sua apresentação clínica e respetivo tratamento.
Pseudoaneurysm of the left ventricular outflow tract (LVOT) is a rare disease with high morbidity and mortality, resulting from left ventricular damage due to myocardial infarction, infective endocarditis or surgical trauma. A case of giant pseudoaneurysm of the LVOT, even more rarely reported in the literature, is described. The lesion was detected 12 years after aortic valve replacement for infective endocarditis in a young patient, a former intravenous drug user. As it is an uncommon disease, little is known about its clinical presentation and treatment.
Paciente de 45 anos, do sexo masculino, engenheiro, ex-toxicodependente, portador de hepatopatia crónica por vírus C e com história pregressa de troca da válvula aórtica metálica em maio de 1998 por endocardite infecciosa. Após 7 meses, evoluiu com deiscência perivalvular, tendo sido submetido a nova cirurgia, para implante de prótese em aorta ascendente com patch. Em 2009, apresentou fibrilação atrial persistente, com tentativas de cardioversão química e elétrica sem sucesso.
Em 2010, foi admitido na nossa instituição para investigação diagnóstica de quadro de tosse seca progressiva, estando em tratamento de pneumonia.
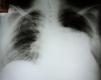
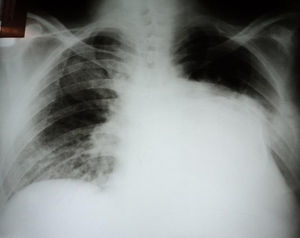
Foi iniciada a propedêutica com radiografia simples ao tórax, que evidenciou imagem radiopaca na base e terço médio do hemitórax esquerdo (Figura 1). O eletrocardiograma de 12 derivações mostrou ritmo de fibrilação atrial e sobrecarga do ventrículo esquerdo (VE). Os exames laboratoriais encontravam-se normais, sem anemia, leucocitose ou alterações eletrolíticas.
Realizou-se ecocardiograma transesofágico que revelou disfunção sistólica do VE (fração de ejeção do ventrículo esquerdo [FEVE]=38%), átrio esquerdo (AE) com aumento moderado (AE=50mm) e presença de dilatação importante da aorta ascendente, com 88mm no seu diâmetro maior, bem como imagem indicativa de fluxo entre o tubo protético aórtico e a aorta ascendente.
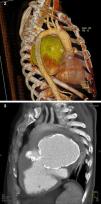
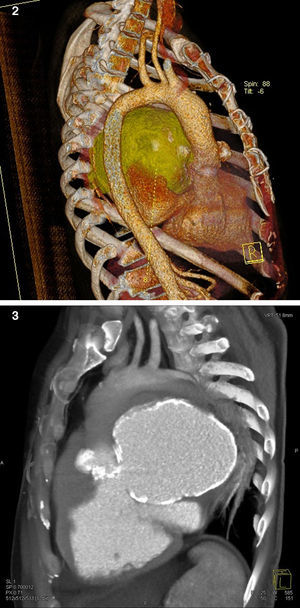
Seguidamente, o paciente foi submetido a uma angiotomografia, a qual mostrou um volumoso pseudomaneurisma junto à porção fibrosa intervalvular mitroaórtico (FIMA), que apresentava comunicação principalmente com o VE (Figuras 2 e 3). Este pseudoaneurisma determinava compressão do tronco da artéria pulmonar, da artéria pulmonar esquerda, do brônquio fonte esquerdo, estruturas broncovasculares da língula e lobo inferior do pulmão esquerdo. Havia ainda desvio de estruturas mediastinais para a esquerda.
Complementou-se o estudo diagnóstico com uma cineangiocoronariografia, que evidenciou coronárias anatomicamente normais, ventriculografia e aortografia, que mostraram cavidade ventricular normal, com moderada hipocontratilidade ínfero-lateral e refluxo de contraste para uma cavidade sugestiva de pseudoaneurisma gigante fazendo conexão com o VE, com paredes calcificadas e sem obstáculo a ejeção ventricular.
Durante este período, o paciente manteve-se estável hemodinamicamente. Perante a importante compressão de estruturas vizinhas ao pseudoaneurisma gigante e associada a repercussão clínica, optou-se por intervenção cirúrgica.
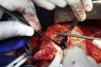
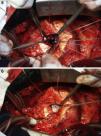
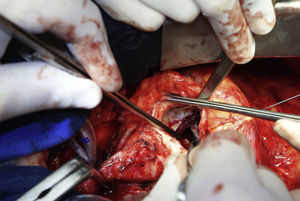
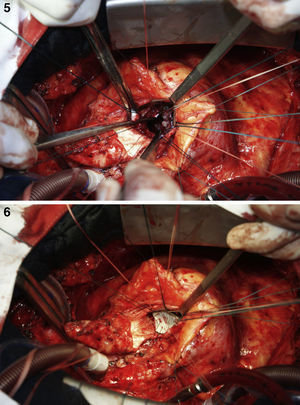
Em 5 de outubro de 2010, o paciente foi submetido a cirurgia cardiovascular com circulação extracorpórea (CEC), hipotermia a 23°C e, após pinçamento aórtico, infusão de cardioplegia sanguínea hiperpotassémica a 5°C nos óstios coronários. Foi retirada a prótese aórtica, permitindo a visualização do orifício de aproximadamente 1,5cm de diâmetro (Figura 4). Optou-se pela oclusão do orifício com tecido de Dacron (Figuras 5 e 6) e implante da nova prótese aórtica metálica St Jude 23, com posterior sutura da aorta e reaquecimento a 37°C.
O paciente evoluiu com fibrilação ventricular repetidamente, necessitando de vários choques de 20 J, mantendo-se instável hemodinamicamente, com hipocontratilidade visualmente importante e grande dificuldade para sair de CEC. Foi iniciada a infusão venosa de noradrenalina e vasopressina para manter os níveis tensionais.
Na unidade de terapia intensiva, necessitou de doses máximas de drogas vasoativas, tendo sido indicada a utilização de balão intra-aórtico e a monitorização com cateter de Swan-Ganz. Evoluiu com Síndrome da Resposta Inflamatória Sistémica, traduzida por hipertermia, coagulopatia, insuficiência hepática e renal. No 3.° d de pós-operatório (DPO), o paciente manteve-se estável clinicamente, tendo sido ampliada a antibioticoterapia e suspensa a sedação. Apresentou no 4.o DPO arreatividade neurológica, com confirmação de morte encefálica em 11 de outubro de 2010.
DiscussãoO pseudoaneurisma da VSVE é uma complicação rara, porém de alta letalidade. Foi primeiramente descrito em 1969 no postmortem por Lewis et al.1, que descreveu 3 casos de impending rupture numa série de estudos de autópsia de 1 228 pacientes com infarto agudo do miocárdio (IAM). Em 1988, Savage et al. reportou o diagnóstico no antemortem com o tratamento bem-sucedido, sendo então definida essa patologia como pseudoaneurisma2. A sua incidência não é conhecida exatamente, sabe-se, porém, que é ainda menos frequente do que a rutura cardíaca após IAM, a qual tem uma incidência de 2 a 4%.
O pseudoaneurisma da VSVE tem origem na rutura do miocárdio não transmural, com cavidade circundada por músculo cardíaco, mantendo-se íntegro devido à presença de pericárdio aderente ou de tecido cicatricial presente na parede livre do VE. Geralmente, ocorre após IAM (sendo esta a principal causa), trauma torácico, cirurgia cardíaca (equivalente a 1/3 dos casos)3, endocardite infecciosa, podendo apresentar-se ainda como doença cardíaca congénita. Há uma predisposição para áreas que sofreram manipulação cirúrgica, por uma deiscência da FIMA4,5. Os pacientes que foram submetidos a reoperação da válvula aórtica possuem uma incidência maior (porém, não significativa) de pseudoaneurisma quando comparados com pacientes operados uma única vez (83 e 58%, respetivamente).
A endocardite valvular é a patologia que promove maior incidência de FIMA, levando secundariamente ao pseudoaneurisma. Por ser uma região pouco vascularizada, torna-se mais susceptível à infeção. A contaminação ocorre tanto por contiguidade com a parede aórtica, quanto por disseminação pelo jato regurgitante a estruturas subaórticas e folheto anterior da válvula mitral.
A insuficiência cardíaca congestiva é a manifestação clínica mais comum, seguida da dor torácica, dispneia, hemoptise e, em alguns casos, o primeiro sintoma pode ser morte súbita. Em aproximadamente 12% das situações, os doentes apresentam-se assintomáticos ao diagnóstico4.
Uma vez formado, o pseudoaneurisma começa a causar um stresse adicional na parede da aorta com um risco potencial de rutura. Ao romper para o pericárdio, pode causar tamponamento cardíaco; no átrio tende a formar um jato excêntrico de regurgitação mitral e na aorta resulta em fístula comunicando a cavidade ventricular com a aorta. Todas estas condições correlacionam-se com alta morbidade e mortalidade. O pseudoaneurisma também predispõe a embolização e a infeção. Em alguns casos, a lesão pode permanecer intacta e tornar-se crónica, aparecendo como uma cavidade pulsátil com expansão na sístole. Há ainda relatos de compressão das artérias coronárias causando sintomas isquémicos. Nesses doentes, a causa de morte mais habitual parece ser a insuficiência cardíaca e a doença coronariana, ao invés da rutura do miocárdio6.
Os métodos diagnósticos disponíveis incluem: ecocardiograma, cateterismo, tomografia computorizada e ressonância magnética. A angiografia apresenta-se como método diagnóstico padrão ouro, sendo, contudo, invasiva e de maior custo3. O ecocardiograma tridimensional também é uma alternativa, apesar de existirem poucos relatos sobre a sua eficácia no diagnóstico do pseudoaneurisma e respetivas complicações.
Por ser uma patologia de alta morbimortalidade, com elevado risco de complicações graves e potencialmente fatais, a maioria dos estudos recomenda a correção cirúrgica do pseudoaneurisma2,7–9. A sobrevida é reduzida, caso não se realize cirurgia de correção7. A mortalidade cirúrgica aceitável é de 7-23% após o aperfeiçoamento das técnicas cirúrgicas. Porém, em alguns casos, foi descrita a resolução espontânea do pseudoaneurisma10.
No caso de pacientes com pseudoaneurisma crónico (mais de três meses de evolução), clinicamente estáveis, alguns autores sugerem um tratamento não invasivo com seguimento frequente, o qual reduz o risco de complicações e a mortalidade. A intervenção cirúrgica nestes pacientes está indicada na presença de complicações (taquiarritmias ou embolismo recorrente), quando há indicação cirúrgica por outro motivo, ou quando é diagnosticado em menos de três meses após o IAM6.
Descreveu-se um caso de pseudoaneurisma de VSVE gigante. A lesão foi detetada 12 anos após a troca da válvula aórtica por endocardite infecciosa num paciente jovem e ex-toxicodependente. Por ser uma patologia incomum, com poucos casos relatados na literatura, pouco se sabe sobre a sua apresentação clínica e respetivo tratamento.
Conflito de interessesOs autores declaram não haver conflito de interesses.