A inflamação vascular tem um papel crucial na patogénese da aterosclerose e medeia vários dos estadios de desenvolvimento da placa de ateroma, desde a formação da estria lipídica à destabilização e rotura da placa que precede as síndromes clínicas da doença cardiovascular. Os biomarcadores inflamatórios constituem uma ferramenta valiosa para acompanhar a evolução deste processo, permitindo mensurar o efeito das diversas atitudes terapêuticas implementadas. Neste contexto, a proteína C reativa (PCR), determinada por métodos de alta sensibilidade (PCR-as), é o biomarcador mais extensamente estudado. Os dados relativos à associação entre PCR-as e risco cardiovascular são amplamente consistentes, embora apresentem relevância clínica incerta. Este artigo fornece uma revisão abrangente da evidência existente sobre PCR-as e risco cardiovascular, no que respeita a prevenção primária e secundária, e conclui com uma análise baseada na evidência sobre o papel atual da PCR-as na avaliação do risco cardiovascular.
Vascular inflammation plays a crucial role in the pathogenesis of atherosclerosis and mediates various stages of atherosclerotic plaque development, from lipid streak formation to the plaque rupture and destabilization that precedes the clinical syndromes of cardiovascular disease. Inflammatory biomarkers constitute valuable tools to study this process, enabling the effects of different therapeutic interventions to be assessed. Currently, C-reactive protein (CRP) determined by high-sensitivity methods (hs-CRP) is the most extensively studied biomarker. Data regarding hs-CRP and cardiovascular risk, though largely consistent, are of unclear clinical relevance. This article provides a comprehensive review of current knowledge concerning cardiovascular risk and hs-CRP, and concludes with an evidence-based analysis of the current role of hs-CRP in cardiovascular risk assessment.
Outrora considerada como resultante de um processo passivo de acumulação lipídica, sabe-se atualmente que a aterosclerose se desenvolve como um processo ativo de ativação celular, inflamação e trombose1. A inflamação é o mecanismo chave na patogénese dos vários estadios da aterosclerose, incluindo o início, a progressão do ateroma, a instabilidade da placa e subsequente rotura e, após angioplastia, a reestenose2–4. O processo inflamatório é exacerbado por todos os fatores de risco cardiovasculares identificados em estudos epidemiológicos, particularmente pelos níveis elevados de colesterol-LDL1. Evidências crescentes sugerem que a modificação destes fatores de risco, suporte clínico da prevenção dos eventos ateroscleróticos, suprime a inflamação5.
No entanto, o processo inflamatório aterosclerótico é difícil de ser diretamente mensurado. Não existem técnicas de imagem que possibilitem monitorizar as alterações inflamatórias e a biópsia arterial não é um método prático nem ético para o estudar ou para monitorizar as intervenções terapêuticas. Neste contexto, surgiu um interesse crescente pelos biomarcadores de inflamação, proteínas plasmáticas passíveis de serem quantificadas a partir do sangue periférico.
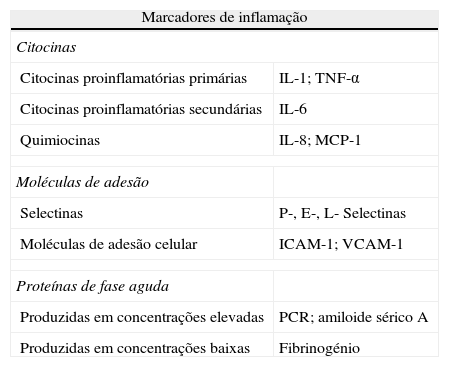
A explosão dos biomarcadores inflamatóriosOs biomarcadores inflamatórios providenciam informação útil acerca do processo inflamatório aterosclerótico, constituindo uma «janela» para o processo de ativação celular, recrutamento de células inflamatórias e proliferação6. Eles são potencialmente produzidos pelas células inflamatórias e vasculares da placa ou, indiretamente, em outros órgãos, tais como o fígado ou o baço. Contudo, sendo um processo não específico, a inflamação de outros tecidos ou órgãos conduz ao aumento destes biomarcadores, confundindo assim a relação plasmática destes com o processo inflamatório indolente das síndromes ateroscleróticas estáveis, tendo sido necessário desenvolver metodologias de «alta sensibilidade» para se detetarem pequenas variações na concentração plasmática destas moléculas, em indivíduos não infetados, relacionáveis com estes processos. O desenvolvimento dos biomarcadores de inflamação veio complementar o estudo dos marcadores de lesão tecidular (troponina), dos marcadores de trombose e trombólise (ativador do plasminogénio tecidular) ou dos marcadores de oxidação lipídica (LDL-oxidada). Em conjunto, estes biomarcadores fornecem informação essencial sobre o processo aterosclerótico. Apesar de a lista dos biomarcadores inflamatórios ser extensa e se encontrar em contínuo crescendo (Tabela 1), a proteína C reativa (PCR) constitui o biomarcador mais extensamente estudado, e será ela o objeto desta revisão.
Marcadores de inflamação
| Marcadores de inflamação | |
| Citocinas | |
| Citocinas proinflamatórias primárias | IL-1; TNF-α |
| Citocinas proinflamatórias secundárias | IL-6 |
| Quimiocinas | IL-8; MCP-1 |
| Moléculas de adesão | |
| Selectinas | P-, E-, L- Selectinas |
| Moléculas de adesão celular | ICAM-1; VCAM-1 |
| Proteínas de fase aguda | |
| Produzidas em concentrações elevadas | PCR; amiloide sérico A |
| Produzidas em concentrações baixas | Fibrinogénio |
A PCR é o biomarcador inflamatório melhor estudado na doença coronária. Nas últimas décadas, mais de 30 estudos epidemiológicos demonstraram que a PCR está associada ao aumento do risco cardiovascular7. A molécula possui determinadas características que a tornam particularmente atrativa. É uma proteína de fase aguda positiva, marcador de inflamação sistémica, que aumenta em resposta a diversos tipos de lesão, muito em particular a infeções bacterianas, situações clínicas que constituem estímulos inflamatórios8. A sua produção hepática é principalmente estimulada pela IL-6 e, ao contrário de outros marcadores de fase aguda, os seus níveis permanecem relativamente estáveis, sem grande variação diurna, permitindo a sua correta quantificação9. O termo PCR de alta sensibilidade (PCR-as) é o termo aplicado ao método desenvolvido nos anos 90, que deteta concentrações séricas de PCR em níveis mais baixos que os métodos laboratoriais prévios. O seu limiar de deteção é muito baixo (de 0,3 mg/L), pelo que deve ser este o método laboratorial utilizado quando se pretende avaliar o risco cardiovascular associado à inflamação vascular sistémica crónica da aterosclerose.
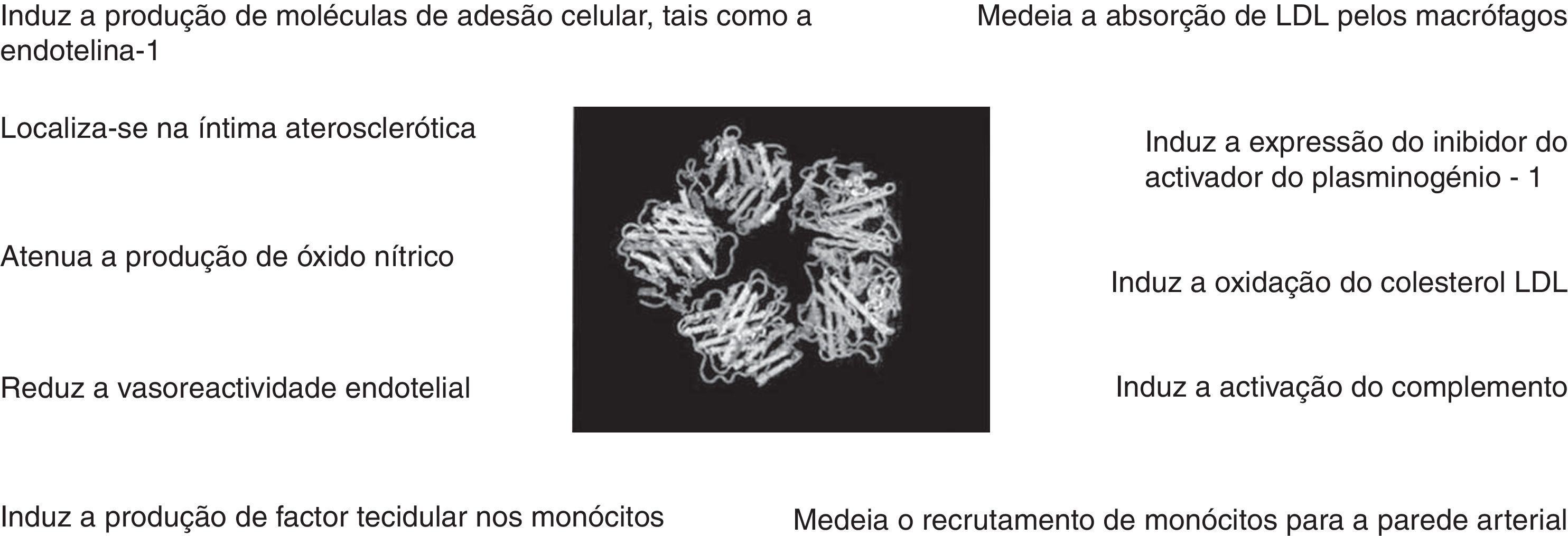
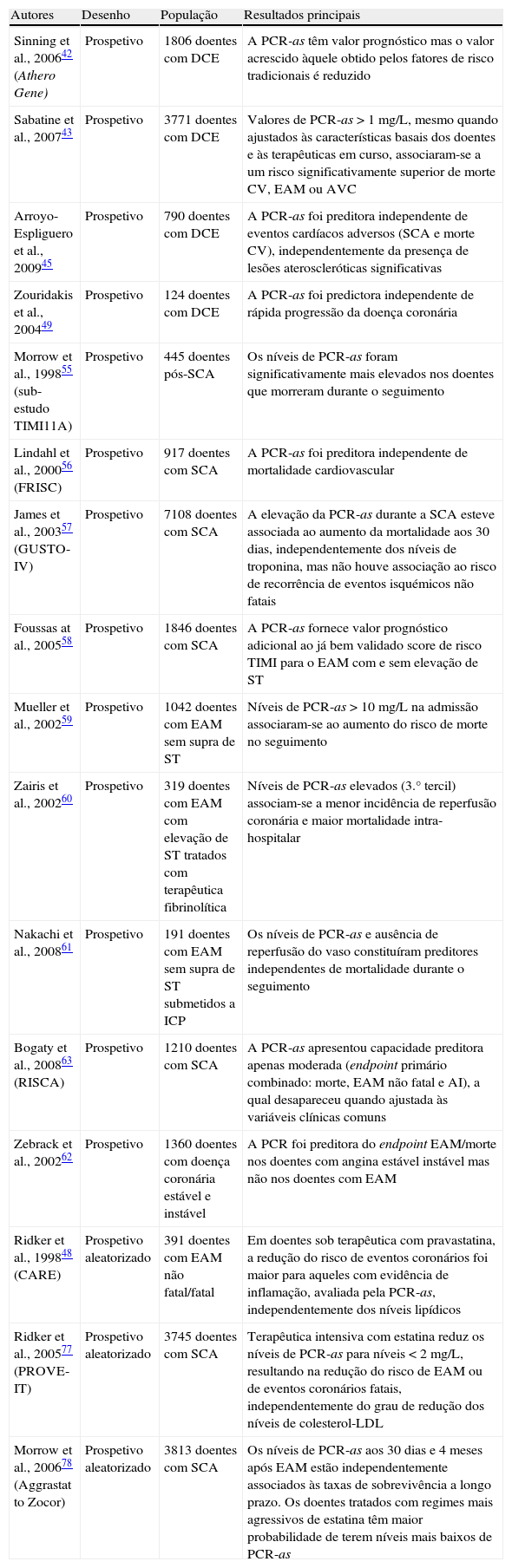
Evidências crescentes sugerem que a PCR não é apenas um marcador inflamatório, mas também que a molécula participa ativamente no processo aterogénico (Fig. 1)10,11. Ishikawa et al. concluíram, em 2003, que a PCR se localiza dentro da placa aterosclerótica, tendo um papel importante na vulnerabilidade desta, assim como na reestenose pós-angioplastia10. De forma semelhante, Inoue et al., em 2005, demonstraram que a PCR é produzida na placa aterosclerótica responsável pela síndrome coronária aguda (SCA), documentando a existência de um gradiente de PCR na circulação arterial coronária distal e proximal à placa11. No mesmo estudo, um gradiente transcardíaco (seio coronário – sangue periférico) aumentou gradualmente após a realização de angioplastia, alcançando o máximo às 48h, sugerindo uma origem cardíaca da PCR11. Os seus níveis correlacionam-se de forma direta com vários fatores de risco cardiovasculares, tais como: o índice de massa corporal, o tabagismo, a pressão arterial sistólica, os níveis de triglicéridos e de colesterol total, a frequência cardíaca, os níveis de glicemia em jejum e a história de doença coronária ou acidente vascular cerebral (AVC) e de forma inversa com os níveis de colesterol-HDL e de pressão arterial diastólica, tanto em crianças como em adultos12–14.
Proteína C reativa e prevenção primáriaVários estudos prospetivos, realizados em indivíduos aparentemente saudáveis, mostraram que níveis elevados de PCR-as se correlacionam positivamente com o risco de morbilidade e mortalidade cardiovascular. O estudo MRFIT (Multiple Risk Factor Interventional Trial) concluiu que o aumento da PCR-as foi preditor do aumento do risco de doença cardiovascular em homens de meia-idade, mas esta relação foi estatisticamente significativa apenas para os fumadores15. O Physician's Health Study (PHS), um estudo prospetivo controlado de indivíduos sem doença cardiovascular e com percentagem reduzida de fumadores, revelou que os doentes com níveis basais de PCR-as mais elevados tinham duas vezes maior risco de sofrerem um acidente vascular cerebral (AVC), três vezes maior risco de enfarte agudo do miocárdio (EAM) e quatro vezes maior risco de desenvolver doença arterial periférica grave. O risco cardiovascular não foi influenciado pelos hábitos tabágicos e foi independente dos níveis lipídicos16. Posteriormente, o estudo MONICA-Augsburg, um estudo prospetivo de 936 indivíduos saudáveis, de meia-idade, sem evidência clínica de doença coronária, demonstrou um aumento de 19% no risco de eventos coronários fatais e não fatais por cada aumento do desvio padrão da PCR-as, depois de ajustado para múltiplos fatores de risco cardiovasculares, incluindo os hábitos tabágicos17. Mais recentemente, no estudo prospetivo PREVEND, 8139 indivíduos sem doença coronária prévia documentada foram seguidos para a ocorrência de angiografia coronária e eventos coronários, de 1997 a 2003. Os níveis de PCR-as associaram-se às características angiográficas e às consequências clínicas da instabilidade da placa, durante o seguimento18. No estudo Womens¿s Health Study (WHS), realizado em mulheres pós-menopáusicas, concluiu-se que a PCR-as foi o mais forte preditor de risco cardiovascular, quando comparado com outros fatores de risco, como os níveis lipídicos e de homocisteína. Uma análise do subgrupo de mulheres com níveis de colesterol-LDL < 130 mg/L, tradicionalmente considerado de baixo risco, mostrou que aquelas com níveis de PCR-as elevados tinham maior risco de desenvolverem eventos agudos futuros. O estudo de seguimento da população total mostrou que a PCR-as foi forte preditora de eventos cardiovasculares, mais do que os níveis de colesterol-LDL19,20. Baseados nos estudos PHS e WHS, o risco relativo ajustado de eventos cardiovasculares futuros aumenta 26% nos homens e 33% nas mulheres, por cada aumento do quartil dos níveis de PCR-as21.
Mais recentemente, Ridker et al. avaliaram o poder preditivo de fatores de risco não tradicionais na predição dos eventos cardiovasculares, numa população também exclusivamente feminina, constituída por 24 558 mulheres saudáveis. Do estudo resultou um score de predição de risco cardiovascular, que reclassifica 40-50% das mulheres antes classificadas como de risco intermédio em categorias de risco alto ou baixo. O score simplificado incluiu: a idade, a pressão arterial sistólica, a hemoglobina A1c, os hábitos tabágicos, os níveis de colesterol-HDL e total, a PCR-as e história familiar de EAM em idade precoce (< 60 anos) – Reynolds risk score. Este score apresentou acuidade prognóstica superior aos modelos baseados nos scores preditivos tradicionais22. Um score semelhante, que incluiu a PCR-as e a história familiar de EAM, foi também avaliado em homens e, de forma semelhante, constatou-se possuir capacidade preditiva do risco cardiovascular global significativamente superior à dos modelos tradicionais23.
Para avaliar o papel da PCR-as em contexto de síndrome metabólica, um estudo recente avaliou a relação entre os níveis de PCR-as, a presença de síndrome metabólica e eventos cardiovasculares (EAM, AVC, revascularização coronária e morte cardiovascular), em 14 719 mulheres aparentemente saudáveis, 24% das quais com síndrome metabólica, seguidas por um período de oito anos. De forma sumária, os níveis de PCR-as foram preditores de eventos cardiovasculares futuros, sobretudo naquelas com síndrome metabólica na admissão do estudo24, conclusão partilhada por um estudo posterior25. Para além de preditivos de fenómenos trombóticos, os níveis de PCR-as foram também preditores de diabetes mellitus tipo 226, doença que partilha alguns dos mecanismos inflamatórios com a aterosclerose, podendo ter implicações no futuro, nomeadamente no que respeita aos alvos terapêuticos a atingir no controlo da diabetes. Finalmente, parece que a PCR-as pode ser um marcador útil de rasteio de crianças em risco de desenvolver doença coronária em idade adulta27.
Em conclusão, estes dados sugerem que os níveis de PCR-as adicionam valor prognóstico aos fatores de risco clássicos, nomeadamente aos parâmetros lipídicos, e podem ser úteis na identificação dos doentes em risco de desenvolver eventos cardiovasculares futuros, mesmo naqueles que previamente seriam classificados como de risco baixo ou intermédio.
Todavia, estes resultados não são consensuais. Estudos diferentes concluíram que o valor preditor da PCR-as é relativamente baixo e que a sua capacidade preditiva adicional aos fatores de risco convencionais, no doente individualmente considerado, é reduzida28–31. Assim, de acordo com estes autores, o enfoque na prática clínica diária deve manter-se na abordagem dos fatores de risco clássicos (pressão arterial, lípidos, hábitos tabágicos, etc.)28–31. Em 2010, Stefan Blankenberg et al., no estudo Contribution of 30 Biomarkers to 10-Year Cardiovascular - Risk Estimation in 2 Population Cohorts, concluíram que nenhum dos 30 biomarcadores avaliados (incluindo a PCR-as) adicionou valor prognóstico aos scores preditivos tradicionais. Contudo, uma estratégia baseada na adição de um score de três biomarcadores (PCR-as, troponina I e BNP) a um modelo de risco convencional melhorou a estimativa do risco de eventos cardiovasculares a 10 anos, em duas populações europeias de meia-idade32 (Tabela 2).
Principais estudos de prevenção primária
| Estudo | Desenho | População | Resultados principais |
| Kuller LH et al., 199615 (MRFIT) | Prospetivo | 491 homens AS | A PCR-as foi preditora do risco de morte CV (relação estatisticamente significativa apenas para os fumadores) |
| Ridker et al., 199716 (PHS) | Prospetivo | 543 homens AS | Os níveis de PCR-as foram preditores da ocorrência de AVC, EAM e doença arterial periférica grave |
| Koenig et al., 199917 (MONICA-Augsburg) | Prospetivo | 936 homens AS | Aumento de 19% do risco de eventos coronários fatais e não fatais por cada aumento do desvio padrão da PCR-as |
| Geluk et al., 200818 (PREVEND) | Prospetivo | 8139 homens e mulheres AS | Os níveis de PCR-as associaram-se às características angiográficas e às consequências clínicas da instabilidade da placa aterosclerótica |
| Ridker et al., 200019 (WHS) | Prospetivo | 28 263 mulheres pós- menopausa AS | PCR-as foi a mais forte preditora do risco CV, mesmo no subgrupo de mulheres com níveis de colesterol-LDL < 130 mg/L |
| Ridker et al., 200220 | Prospetivo | 27 939 mulheres AS | A PCR-as foi melhor preditora de eventos CV que o colesterol-LDL e acrescenta informação prognóstica ao score de Framingham |
| Ridker et al., 200722 | Prospetivo | 24 558 mulheres AS | O novo score de predição de risco CV, Reynolds risk score, que incorpora a PCR-as, reclassifica 40-50% das mulheres antes classificadas como de risco intermédio em categorias de risco alto ou baixo e é superior aos scores de risco clássicos |
| Ridker et al., 200823 | Prospetivo | 10 724 homens AS | O modelo preditor Reynolds risk score for men, que incorpora a PCR-as, aumenta a previsão do risco CV global relativamente aos scores de risco clássicos |
| Ridker et al., 200324 | Prospetivo | 14 719 mulheres AS (24% das quais com síndrome metabólico) | PCR-as identifica os doentes com síndrome metabólica com risco de eventos CV superior |
| Danesh et al., 200429 | Prospetivo | 3969 homens e mulheres AS | A PCR-as tem capacidade preditora de eventos CV apenas moderada, não significativamente superior aos fatores de risco clássicos |
| Lloyd-Jones et al., 200630 | Meta-análise de estudos prospetivos (de 1966 a 2005) | A PCR-as não tem capacidade preditora de eventos CV superior ao score de Framingham. Naqueles com risco CV intermédio (10% a 20% a 10 anos), níveis de PCR-as > 3,0 mg/L podem indicar risco acrescido. | |
| Wang et al., 200631 | Prospetivo | 3209 homens e mulheres AS | A capacidade predictora adicional da PCR-as aos factores de risco CV clássicos é apenas moderada |
| Blankenberg et al., 201032 | Prospetivo | 7915 homens e mulheres AS | A PCR-as não adicionou valor prognóstico aos scores preditivos tradicionais |
| Ridker et al., 200164 (AFCAPS/TexCAPS) | Prospetivo aleatorizado | 5742 homens e mulheres AS | Os indivíduos com níveis de PCR-as elevados, independentemente dos níveis de colesterol, apresentaram maior risco de eventos CV e beneficiaram da aleatorização no grupo lovastatina |
| Albert et al., 200165 (PRINCE) | Prospetivo aleatorizado | 1702 homens e mulheres AS | A pravastatina reduziu os níveis de PCR-as em indivíduos sem história pregressa de doença CV, de forma independente do colesterol |
| Ridker et al., 200870 (JUPITER) | Prospetivo aleatorizado | 17 802 homens e mulheres AS (com colesterol LDL < 130 mg/DL e PCR-as > 2 mg/L) | A rosuvastatina (vs placebo) reduziu o endpoint primário de EAM, hospitalização por AI, revascularização arterial, AVC e morte CV |
| Mora et al., 201071 (sub-estudo JUPITER) | Prospetivo aleatorizado | Idem | A redução do endpoint primário foi semelhante em homens (42%) e mulheres (46%), não existindo heterogeneidade significativa no efeito do tratamento por sexos |
AI: angina instável; AS: aparentemente saudáveis; AVC: acidente vascular cerebral; CV: cardiovascular; EAM: enfarte agudo do miocárdio.
Em suma, não sendo consensual a utilização da PCR-as em prevenção primária e, não estando clarificado se a sua possível capacidade preditiva superior é clinicamente relevante, isto é, conduz a uma diminuição da morbimortalidade cardiovascular, a sua utilização rotineira na prática clínica diária exige validação em grande escala33.
Proteína C reativa e prevenção secundáriaDoença coronária estávelTem sido consistentemente demonstrado que a PCR-as é um marcador de prognóstico de eventos adversos, nos doentes com doença coronária estável (DCE). No entanto, a sua associação à extensão da doença coronária, avaliada quer por angiografia invasiva quer por tomografia computorizada, não é consensual, existindo estudos que a defendem34–36 e outros que a refutam37–39. Ainda assim, foi demonstrado recentemente que os níveis de PCR-as se correlacionam inversamente com o grau de colaterização da circulação coronária40,41.
Um estudo efetuado em 2007, por Sinning et al., avaliou o valor da PCR-as e do fibrinogénio no prognóstico da DCE, tendo sido concluído que os marcadores inflamatórios têm valor prognóstico, mas que o valor acrescido àquele obtido pelos fatores de risco tradicionais é reduzido42. Mais recentemente, uma subanálise do estudo Prevention of Events with Angiotensin Converting Enzyme Inhibition, um estudo aleatorizado controlado por placebo, que inclui 3771 doentes seguidos por um período de 4,8 anos, demonstrou que valores de PCR-as >1mg/L, mesmo quando ajustados às características basais dos doentes e às terapêuticas em curso, se associavam a um risco significativamente superior de morte cardiovascular, EAM ou AVC43.
Estudos adicionais revelaram que a PCR-as se correlaciona de forma inversa com a fração de ejeção do ventrículo esquerdo e que constitui um preditor independente de agravamento da classe funcional da New York Heart Association (NYHA), em doentes com DCE referenciados para angiografia coronária eletiva, independentemente da extensão da doença coronária44. Os mesmos autores concluíram que a PCR-as foi preditora independente de eventos cardíacos adversos (SCA e morte cardiovascular), em doentes com DCE, independentemente da presença de lesões ateroscleróticas significativas45. Este facto poderá ser justificado pela ocorrência do remodelling parietal, que se sabe estar associado à evolução da DCE. Neste contexto, foi já demonstrada uma correlação positiva entre PCR-as e o grau de remodelling coronário46, assim como entre PCR-as e a composição da placa aterosclerótica (nomeadamente com a percentagem de tecido necrótico central)47, avaliados por ultrassonografia coronária, em doentes com DCE referenciados para coronariografia eletiva.
Pós-EAM, os marcadores inflamatórios foram também preditores de recorrência de eventos. Já em 1998, Ridker et al. tinham concluído, a partir de um estudo efetuado em 391 doentes, que níveis de inflamação baixos, avaliados pelos níveis de PCR-as e de amiloide sérico A (ASA), eram preditores da recorrência de eventos adversos. Mais especificamente, os doentes com níveis de PCR-as pertencentes ao quartil mais elevado (4.° quartil) apresentavam um risco de recorrência de eventos 75% superior relativamente àqueles cujos níveis de PCR-as se encontravam no quartil mais baixo (p=0,02 para a PCR e ASA). Curiosamente, os níveis lipídicos foram semelhantes entre aqueles com e sem evidência de inflamação48. Adicionalmente, os níveis séricos de PCR-as foram também preditores independentes de rápida progressão da doença coronária. Esta associação foi sugerida em 2004 por Zouridakis et al., num estudo efetuado em 124 doentes com DCE, que aguardavam realização de coronariografia de forma eletiva (tempo médio de espera: 4,8 meses). A rápida progressão da doença coronária, que ocorreu em 35 doentes (28%) foi definida como: redução ≥ 10% do diâmetro do lúmen numa estenose preexistente ≥ 50%, redução ≥ 30% do diâmetro do lúmen numa estenose preexistente < 50%, desenvolvimento de uma estenose de novo ≥ 30% ou progressão de qualquer estenose para oclusão total49.
Finalmente, os níveis de PCR-as correlacionaram-se com a presença de isquemia miocárdica induzida pelos testes de sobrecarga. Doentes com níveis de PCR-as no quintil mais elevado (>3,8mg/L) apresentaram maior probabilidade de indução de isquémia relativamente aos que tinham PCR-as no quintil mais baixo (< 0,7 mg/L; 75 versus 38%)50. É interessante salientar que esta associação foi significativa apenas para os doentes que não estavam medicados com estatina ou beta-bloqueante.
Doença coronária instávelSabe-se hoje que os níveis de PCR-as se correlacionam com a presença de placa instável, documentada por Doppler carotídeo51 e com o aumento da temperatura nestas placas, avaliada com cateter termogénico invasivo52. A sua relação com a extensão do EAM, avaliada pela subida enzimática ou pela fração de ejeção é, no entanto, mais controversa53,54.
Em contexto de SCA, a PCR-as mostrou, de forma consistente, ser marcador prognóstico de eventos cardíacos adversos, tais como EAM, revascularização urgente, reestenose pós-intervenção coronária percutânea (ICP) ou morte cardiovascular. Morrow et al., no estudo randomizado Thrombosis in Myocardial Infarction 11 (TIMI-11), verificaram que, pós-SCA, os níveis de PCR-as foram significativamente mais elevados nos doentes que morreram durante o seguimento relativamente aos sobreviventes (0,72 mg/L vs 1,3 mg/L, p < 0,001). Além disso, a PCR-as foi preditora independente de mortalidade aos 14 dias, incluindo nos doentes com troponina negativa55. No Fragmin during instability in Coronary Artery Disease (estudo FRISC), a PCR-as foi preditora independente de mortalidade cardiovascular. A mortalidade foi de 5,7% nos doentes com níveis de PCR-as < 2mg/L, 7,8% nos doentes com níveis de PCR-as entre 2 e 10mg/L e 16,5% entre os doentes com PCR-as >10mg/L56. No Global Use of Strategies To open Occluded arteries IV (GUSTO-IV), apesar de a elevação da PCR-as durante a SCA estar associada ao aumento da mortalidade aos 30 dias, independentemente dos níveis de troponina, não houve associação ao risco de recorrência de eventos isquémicos não fatais57, os seja, a PCR-as foi melhor preditora de mortalidade do que de eventos isquémicos não fatais. Foussas et al., em 2005, concluíram que os valores de PCR-as fornecem valor prognóstico adicional ao já bem validado score de risco TIMI para o EAM com e sem elevação de ST, de tal forma que deve ser preconizada uma estratégia baseada na utilização dos dois para estratificação de risco dos doentes com EAM58.
Já em 2002 se verificara que a PCR-as é preditora independente de mortalidade nos doentes com SCA, mesmo quando tratados de forma precoce com revascularização coronária. Num estudo prospetivo de doentes submetidos a ICP precoce pós-EAM sem elevação de ST, níveis de PCR-as > 10mg/L por ocasião da admissão associaram-se ao aumento do risco de morte, no seguimento de 20 meses59. Noutro estudo, que incluiu 319 doentes com EAM com elevação de ST tratados com terapêutica fibrinolítica, percebeu-se que os doentes com níveis de PCR-as elevados (pertencentes ao 3.° tercil) tinham menor incidência de reperfusão coronária e maior mortalidade intra-hospitalar60. Mais recentemente, foram obtidos resultados semelhantes por Hoffman et al. (2008), ao estudarem as relações entre os níveis de PCR-as na admissão, o nível de reperfusão miocárdica (avaliada pelo grau de blush miocárdico após abertura do vaso responsável pelo EAM) e o prognóstico de 191 doentes com EAM sem supradesnivelamento ST, submetidos a ICP61. Os doentes com níveis de PCR-as elevados (> 5mg/L) apresentaram maior frequência de não-reperfusão do vaso e, em análise multivariada, apenas os níveis de PCR-as e ausência de reperfusão do vaso constituíram preditores independentes de mortalidade durante o seguimento61.
No entanto, num estudo prospetivo que incluiu 1360 doentes com doença coronária estável e instável (AI e EAM), o hazard ratio (HR) ajustado para EAM/morte para níveis de PCR-as acima do 1.° tercil foi de 1,8 na angina estável; 2,7 na angina instável (AI) e de apenas 1,0 no EAM62. Mais recentemente, num estudo conduzido por Bogaty et al., em doentes com SCA seguidos durante um ano, os autores concluíram que os valores de PCR-as basais apresentaram capacidade preditora apenas moderada (para o endpoint primário combinado: morte, EAM não fatal e AI), a qual desapareceu quando ajustada às variáveis clínicas comuns63 (Tabela 3).
Principais estudos de prevenção secundária
| Autores | Desenho | População | Resultados principais |
| Sinning et al., 200642 (Athero Gene) | Prospetivo | 1806 doentes com DCE | A PCR-as têm valor prognóstico mas o valor acrescido àquele obtido pelos fatores de risco tradicionais é reduzido |
| Sabatine et al., 200743 | Prospetivo | 3771 doentes com DCE | Valores de PCR-as > 1 mg/L, mesmo quando ajustados às características basais dos doentes e às terapêuticas em curso, associaram-se a um risco significativamente superior de morte CV, EAM ou AVC |
| Arroyo-Espliguero et al., 200945 | Prospetivo | 790 doentes com DCE | A PCR-as foi preditora independente de eventos cardíacos adversos (SCA e morte CV), independentemente da presença de lesões ateroscleróticas significativas |
| Zouridakis et al., 200449 | Prospetivo | 124 doentes com DCE | A PCR-as foi predictora independente de rápida progressão da doença coronária |
| Morrow et al., 199855 (sub-estudo TIMI11A) | Prospetivo | 445 doentes pós-SCA | Os níveis de PCR-as foram significativamente mais elevados nos doentes que morreram durante o seguimento |
| Lindahl et al., 200056 (FRISC) | Prospetivo | 917 doentes com SCA | A PCR-as foi preditora independente de mortalidade cardiovascular |
| James et al., 200357 (GUSTO-IV) | Prospetivo | 7108 doentes com SCA | A elevação da PCR-as durante a SCA esteve associada ao aumento da mortalidade aos 30 dias, independentemente dos níveis de troponina, mas não houve associação ao risco de recorrência de eventos isquémicos não fatais |
| Foussas at al., 200558 | Prospetivo | 1846 doentes com SCA | A PCR-as fornece valor prognóstico adicional ao já bem validado score de risco TIMI para o EAM com e sem elevação de ST |
| Mueller et al., 200259 | Prospetivo | 1042 doentes com EAM sem supra de ST | Níveis de PCR-as > 10 mg/L na admissão associaram-se ao aumento do risco de morte no seguimento |
| Zairis et al., 200260 | Prospetivo | 319 doentes com EAM com elevação de ST tratados com terapêutica fibrinolítica | Níveis de PCR-as elevados (3.° tercil) associam-se a menor incidência de reperfusão coronária e maior mortalidade intra-hospitalar |
| Nakachi et al., 200861 | Prospetivo | 191 doentes com EAM sem supra de ST submetidos a ICP | Os níveis de PCR-as e ausência de reperfusão do vaso constituíram preditores independentes de mortalidade durante o seguimento |
| Bogaty et al., 200863 (RISCA) | Prospetivo | 1210 doentes com SCA | A PCR-as apresentou capacidade preditora apenas moderada (endpoint primário combinado: morte, EAM não fatal e AI), a qual desapareceu quando ajustada às variáveis clínicas comuns |
| Zebrack et al., 200262 | Prospetivo | 1360 doentes com doença coronária estável e instável | A PCR foi preditora do endpoint EAM/morte nos doentes com angina estável instável mas não nos doentes com EAM |
| Ridker et al., 199848 (CARE) | Prospetivo aleatorizado | 391 doentes com EAM não fatal/fatal | Em doentes sob terapêutica com pravastatina, a redução do risco de eventos coronários foi maior para aqueles com evidência de inflamação, avaliada pela PCR-as, independentemente dos níveis lipídicos |
| Ridker et al., 200577 (PROVE-IT) | Prospetivo aleatorizado | 3745 doentes com SCA | Terapêutica intensiva com estatina reduz os níveis de PCR-as para níveis < 2 mg/L, resultando na redução do risco de EAM ou de eventos coronários fatais, independentemente do grau de redução dos níveis de colesterol-LDL |
| Morrow et al., 200678 (Aggrastat to Zocor) | Prospetivo aleatorizado | 3813 doentes com SCA | Os níveis de PCR-as aos 30 dias e 4 meses após EAM estão independentemente associados às taxas de sobrevivência a longo prazo. Os doentes tratados com regimes mais agressivos de estatina têm maior probabilidade de terem níveis mais baixos de PCR-as |
AI: angor instável; AVC: acidente vascular cerebral; CV: cardiovascular; DCE: doença coronária estável; EAM: enfarte agudo do miocárdio; SCA: síndrome coronária aguda.
Baseados nestes dados, podemos concluir que a PCR-as providencia valor prognóstico, a curto e longo prazo, na angina estável, AI e pós-EAM, e que os resultados são controversos na fase aguda do EAM, sugerindo que a medição da PCR-as deverá ser efetuada após ter terminado a reação inflamatória aguda do EAM, de forma a permitir que os seus níveis representem os valores basais.
Proteína C reativa e terapêutica preventiva (primária e secundária)Estudos in vitro e in vivo mostraram que a PCR-as não é apenas marcador de inflamação, mas que também contribui ativamente para o desenvolvimento da placa aterosclerótica, para a sua instabilidade e subsequente formação de trombos, de tal forma que tem sido extensamente investigada a sua relação com fármacos cardioprotetores. Uma análise do Air Force/Texas Coronary Atherosclerosis Prevention Study (AFCAPS/TexCAPS) mostrou que a terapêutica com estatina, como prevenção primária, diminui diretamente os níveis de PCR-as. Os indivíduos com níveis elevados de colesterol-LDL (independentemente dos níveis de PCR-as) e aqueles com baixos níveis de colesterol-LDL mas com níveis elevados de PCR-as apresentaram maior risco de eventos cardiovasculares no seu seguimento, verificando-se ainda um benefício substancial no grupo aleatorizado para a lovastatina64. No estudo PRINCE, PRavastatin INflammation CRP Evaluation, a pravastatina reduziu os níveis de PCR-as em indivíduos sem história pregressa de doença cardiovascular65.
No entanto, três meta-análises de estudos iniciais de prevenção primária com estatinas concluíram que esta terapêutica não se associou à redução da mortalidade total ou coronária, tanto em indivíduos do sexo feminino como masculino66–68. Além disso, no estudo Management of Elevated Cholesterol in the Primary Prevention Group of Adult Japanese (MEGA), estudo que envolveu muito mais mulheres do que homens, a redução dos eventos foi significativa apenas para os homens69.
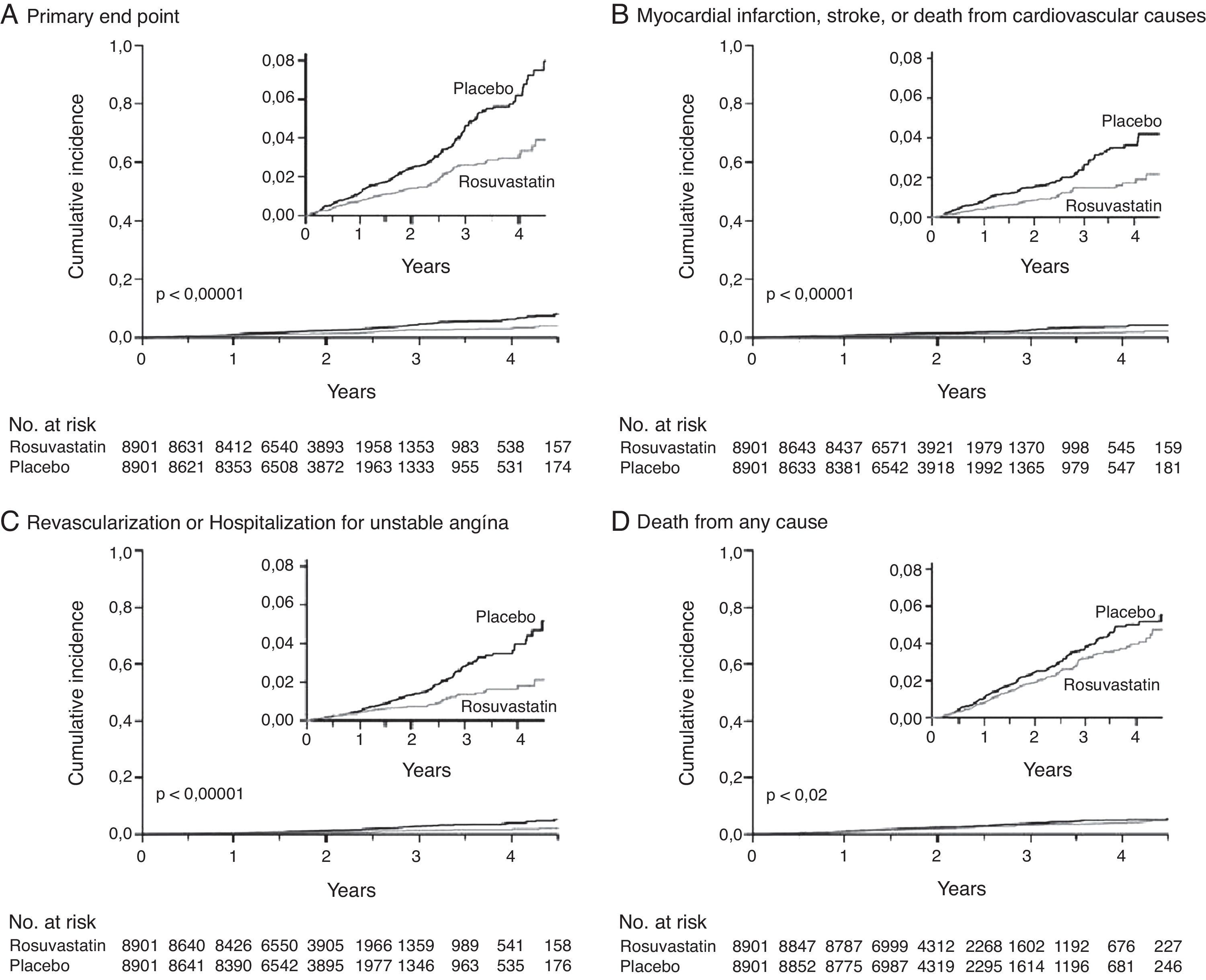
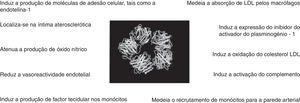
O estudo JUPITER – Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin foi um estudo multicêntrico, aleatorizado, duplamente cego, que incluiu 17 802 indivíduos aparentemente saudáveis, com níveis de colesterol LDL < 130 mg/dL mas com níveis de PCR-as >2 mg/L, tendo sido divididos em dois grupos: rosuvastatina 20 mg/dia ou placebo. Os indivíduos foram seguidos por um período médio de 1,9 anos (máximo 5,0). A rosuvastatina reduziu os níveis de colesterol-LDL em 50% e de PCR-as em 37% e, consequentemente, reduziu de forma significativa a incidência de eventos cardiovasculares major em indivíduos aparentemente saudáveis, sem hiperlipidémia (LDL < 130 mg/dL) mas com níveis elevados de PCR-as. A taxa do endpoint combinado primário (AVC, EAM, AI, revascularização coronária ou morte cardiovascular) foi de 0,77 e 1,36 por cada 100 pessoas/ano de seguimento, nos grupos rosuvastatina e placebo respetivamente (HR para o grupo rosuvastatina: 0,56; IC 95% 0,46-0,69; p < 0,00001) (Fig. 2)70. A redução do endpoint primário foi semelhante nos homens (42%) e nas mulheres (46%), não existindo heterogeneidade significativa no efeito do tratamento por sexos71.
A rosuvastatina reduziu de forma significativa a incidência de eventos cardiovasculares major em indivíduos aparentemente saudáveis, sem hiperlipidémia (LDL < 130 mg/dL) mas com níveis de PCR de alta sensibilidade (PCR-as) elevados (> 2 mg/L). Adaptado de Ridker et al.70.
Duas metanálises posteriores ao estudo JUPITER (nas quais o estudo foi incluído), concluíram que este tratamento se associou à redução do risco relativo de eventos cardiovasculares e ao aumento da sobrevida, semelhante em ambos os sexos71,72.
Assim, alguns autores defendem que o tratamento preventivo com estatinas dos doentes com níveis de PCR-as elevados e níveis de colesterol-LDL normais é custo-eficaz naqueles com Framingham risk score ≥ 10%73,74. Contudo, outros defendem que iniciar terapêutica com estatina sem dosear PCR-as é mais custo-eficaz, assumindo que o fármaco é seguro e que é benéfico mesmo nos doentes com níveis de PCR-as normais75.
É importante salientar que, no estudo JUPITER, apesar de a população ser constituída por indivíduos aparentemente saudáveis, a maioria dos indivíduos incluídos tinha pelo menos uma condição clínica subjacente que elevava o risco cardiovascular, isto é, obesidade e/ou hábitos tabágicos. Assim, de acordo com Rashid S.76, os resultados do JUPITER indicam apenas que a redução adicional do colesterol-LDL em prevenção primária de indivíduos que tenham uma condição preexistente que aumente o risco cardiovascular, mas não apresentem risco elevado de acordo com os modelos de predição atuais, deve ser considerada. As alterações do estilo de vida (cessação tabágica, normalização do peso e alterações na dieta) devem ser prioritárias e anteceder a terapêutica com estatina. Assim, a determinação da PCR-as permite identificar melhor este subgrupo de indivíduos, aos quais se deverá iniciar terapêutica preventiva precocemente, de forma a reduzir a prevalência de doença cardiovascular76.
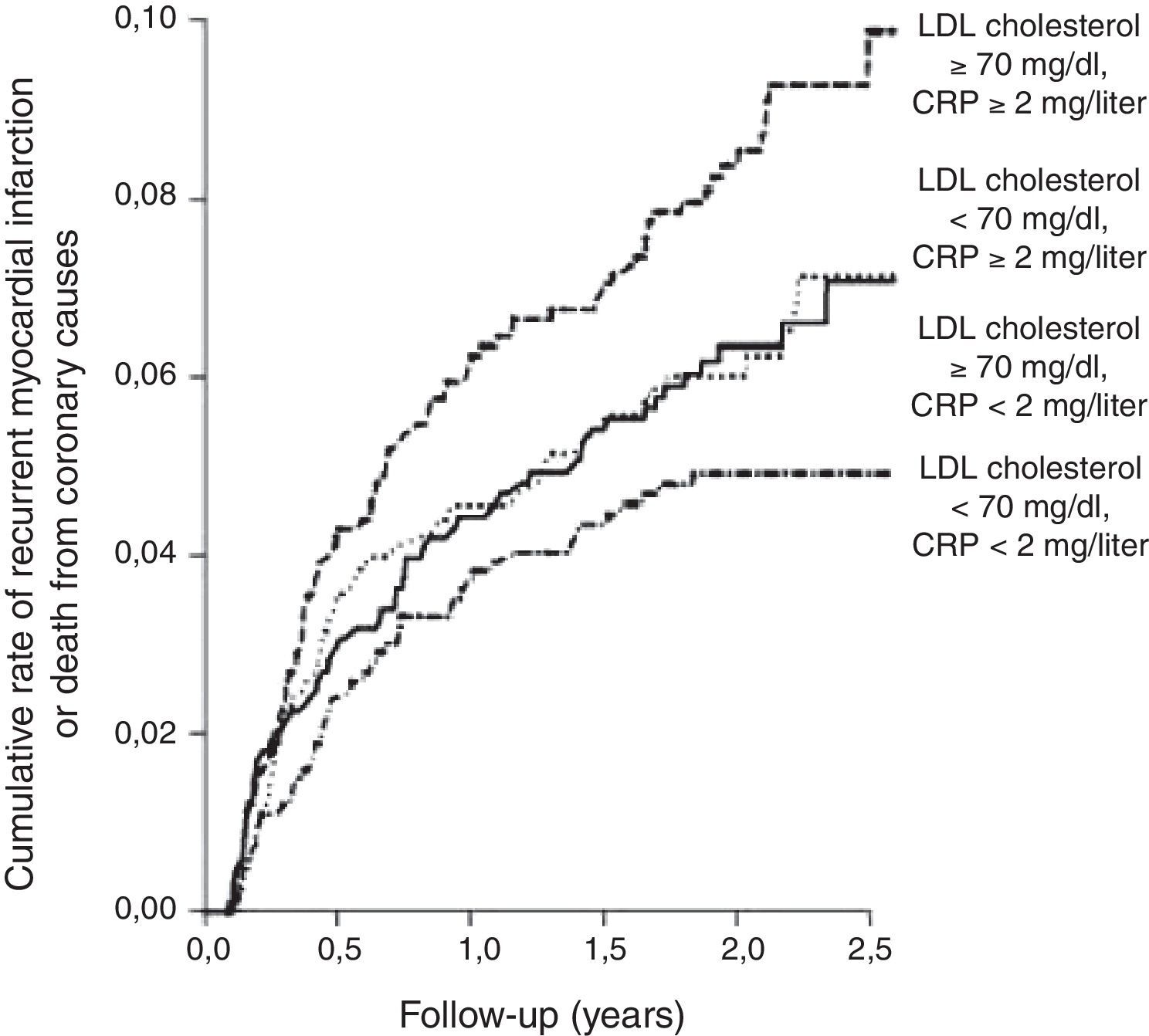
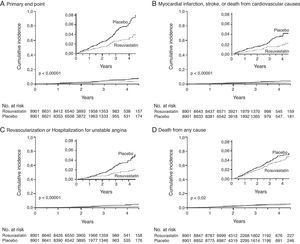
No âmbito da prevenção secundária, os dados do Cholesterol And Recurrent Events (CARE), estudo aleatorizado que avaliou o efeito da pravastatina em doentes pós-EAM, mostraram que, apesar de o risco de eventos coronários adversos ter sido substancialmente reduzido com a terapêutica com estatina entre os doentes com e sem evidência de inflamação, a redução do risco relativo foi maior para aqueles com evidência de inflamação, avaliada pela PCR-as (54 versus 25%), apesar de os níveis lipídicos serem semelhantes nos dois grupos48, o que sugere que a estatina pode ser particularmente eficaz nos doentes com níveis de PCR-as elevados. O estudo PROVE-IT (PRavastatin Or atorVastatin Evaluation and Infection Therapy) demonstrou que a terapêutica intensiva com estatina em doentes com SCA reduz os níveis de PCR-as para níveis inferiores a 2 mg/L, resultando na redução do risco de EAM ou de eventos coronários fatais, independentemente do grau de redução dos níveis de colesterol-LDL (Fig. 3)77. Mais recentemente, uma subanálise do estudo Aggrastat to Zocor mostrou que os níveis de PCR-as aos 30 dias e 4 meses após EAM estão independentemente relacionados com as taxas de sobrevivência a longo prazo, e que os doentes tratados com regimes mais agressivos de estatina têm maior probabilidade de terem níveis mais baixos de PCR-as78. Estes estudos forneceram suporte científico para os efeitos pleotrópicos das estatinas e sugerem que a determinação da PCR-as pode identificar os indivíduos que, não tendo níveis de colesterol-LDL elevados, beneficiam desta terapêutica para redução dos eventos cardiovasculares (Tabela 3).
A terapêutica intensiva com pravastatina, em doentes com síndrome coronária aguda, reduziu os níveis de PCR-as para níveis inferiores a 2 mg/L, resultando na redução do risco de enfarte agudo do miocárdio ou de eventos coronários fatais, independentemente do grau de redução dos níveis de colesterol-LDL. Adaptado de Ridker et al.77.
Relativamente ao ácido acetilsalicílico, no PHS o uso de aspirina® foi associado a uma redução significativamente maior do risco de EAM entre os homens com níveis de PCR-as pertencentes ao quarto quartil relativamente àqueles no quartil mais baixo (55,7 versus 13,9%)16. Contudo, existem atualmente poucos estudos que avaliem o efeito direto do ácido acetilsalicílico nos níveis de PCR-as. Um estudo pequeno, aleatorizado, avaliou o efeito de uma dose baixa de aspirina® em voluntários saudáveis, e não encontrou efeito detetável nos níveis de PCR-as79.
Variabilidade dos níveis de proteína C reactiva de alta sensibilidadeDiversas questões têm sido levantadas, por diferentes grupos, relativamente à flutuação individual dos níveis de PCR-as a curto-prazo (15 dias a 6 meses), em períodos de estabilidade clínica. Os estudos que se debruçaram sobre a variabilidade individual da PCR-as foram realizados em doentes com doença coronária estável80,81, sob tratamento intensivo com estatina81 e ainda em voluntários saudáveis82–85. Concluíram que a variabilidade dos níveis de PCR-as é independente da ocorrência de eventos clínicos, da medicação efetuada, do índice de massa corporal e dos hábitos tabágicos, foi igual entre homens e mulheres e relacionou-se com a idade67,80,86. A variabilidade intraindividual foi de 42-63% em voluntários saudáveis84 e 1,79 mg/L (95% IC 1,60-2,00) entre doentes com cardiopatia isquémica estável81. Além disso, a sua variação não foi corroborada pela variação de outros marcadores de inflamação81.
Estes resultados vieram colocar algumas questões sobre as limitações práticas da utilização deste biomarcador, nomeadamente na predição do risco cardiovascular. Por esta razão, alguns autores recomendam que a determinação do risco de doença coronária se deva efetuar apenas com base nos fatores de risco convencionais28.
Recomendações atuaisEm 2003, a American Heart Association e o Centres for Disease Control and Prevention publicaram um documento em que recomendam de que forma os marcadores inflamatórios devem ser utilizados na avaliação preditiva do risco cardiovascular87. Mais recentemente, em 2009, foram publicadas as orientações sobre «Biomarcadores emergentes para prevenção primária na doença cardiovascular» da National Academy of Clinical Biochemistry Laboratory88.
De acordo com as 2 normas orientadoras, a PCR-as não deve ser determinada na população em geral como forma de determinar o risco cardiovascular, mas poderá ser usada como parte da estratificação do risco cardiovascular em adultos com risco intermédio de doença coronária (10-20% de risco a 10 anos), para suportar a decisão de iniciar ou não estatina como forma de prevenção primária. Os seus valores devem ser expressos em mg/L e os doentes serem classificados de acordo com os seus níveis de PCR-as em: baixo risco (< 1 mg/L), risco intermédio (1-3 mg/L) e risco elevado (> 3 mg/L). Se a concentração de PCR-as for < 3 mg/L, não será necessário repetir a medição. Se a concentração for > 3 mg/L, é aconselhado repeti-la com um intervalo de tempo de 2 semanas, em períodos em que não haja evidência de outros processos inflamatórios sistémicos ativos. O mais baixo dos 2 valores deve ser considerado. Níveis de PCR-as > 10 mg/L sugerem a presença de resposta de fase aguda muito significativa, habitualmente não cardiovascular, requerendo investigação etiológica adicional.
A terapêutica prescrita com base nas concentrações de PCR-as (estatina, aspirina) deve ser baseada apenas no julgamento clínico do médico, porque os seus benefícios são ainda incertos. Além disso, não existem dados suficientes que apoiem a monitorização da terapêutica, em contexto de prevenção primária, utilizando os níveis de PCR-as. Indivíduos com valores persistentemente elevados devem efetuar alterações ao seu estilo de vida, que incluam a perda de peso, exercício físico regular, alimentação saudável e abstenção tabágica, independentemente dos níveis de colesterol-LDL.
Em 2009, a Sociedade Canadiana de Cardiologia também publicou novas orientações sobre Prevenção Cardiovascular Primária89. De acordo com este documento, naqueles com risco cardiovascular intermédio (de acordo com os modelos preditores clássicos), a concentração PCR-as deve ser determinada, adicionalmente aos níveis de colesterol-LDL e HDL, como forma de melhorar a estratificação do risco cardiovascular. A Sociedade Europeia de Aterosclerose permanece silenciosa quanto à sua posição sobre a PCR-as. Pelo contrário, a Sociedade Europeia de Cardiologia, nas suas Orientações sobre Prevenção Cardiovascular, de 2007, considerou que a incorporação da PCR-as e de outros fatores de risco emergentes na predição do risco cardiovascular seria prematura, sendo, portanto, desaconselhada90.
Em fevereiro de 2010, a US Food and Drug Administration (FDA) aprovou a rosuvastatina para prevenção de eventos cardiovasculares em mulheres com idade superior a 60 anos e homens com idade superior a 50 anos, com níveis de PCR-as > 2 mg/L e um fator de risco convencional adicional, mesmo sem hiperlipidémia91.
De acordo com as orientações europeias e americanas, em doentes com doença coronária documentada, a PCR-as poderá ser útil como marcador independente de prognóstico (morte, EAM, reestenose pós ICP)87,92. Todavia, a aplicação de medidas em prevenção secundária ou a utilização das guidelines de SCA não devem estar dependentes dos níveis de PCR-as.
Importa recordar que, recentemente, em 2010, foi publicado um estudo por Hemingway et al., cujo objetivo foi o de avaliar a qualidade dos estudos que se debruçaram sobre o valor prognóstico da PCR-as na doença coronária estável. Os autores concluíram que os 83 estudos avaliados apresentaram vieses (de vários tipos), que fazem com que a importância de qualquer associação independente entre PCR-as e prognóstico na doença coronária estável se torne suficientemente pouco segura para permitir efetuar quaisquer recomendações clínicas93.
ConclusãoEvidências crescentes sugerem que a PCR-as constitui um importante marcador de risco cardiovascular e está fisiopatologicamente associada ao processo aterosclerótico, apresentando valor adicional em prevenção primária e secundária. Apesar das limitações subjacentes à sua utilização clínica diária, nomeadamente no que respeita à sua variabilidade intraindividual e de acordo com os dados atualmente disponíveis, parece útil a determinação seletiva da PCR-as em indivíduos com risco cardiovascular intermédio (10-20% de risco a 10 anos) como forma de otimizar a estratificação do risco e subsequente abordagem clínica.
Responsabilidades éticasProteção dos seres humanos e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver qualquer conflito de interesses.