O movimento anterior sistólico (SAM) é uma complicação pós cirúrgica da valvuloplastia mitral, sendo a sua incidência de 5-10%. O reconhecimento precoce dos sinais e sintomas de SAM é imperativo no delinear de estratégia terapêutica nesses pacientes. Este artigo foca os principais mecanismos fisiopatológicos do SAM dinâmico e modalidades de tratamento descritas na literatura. Os autores descrevem um caso clínico e as imagens ecocardiográficas captadas ilustrando a relevância clínica do mecanismo envolvido, na tentativa de esclarecer uma questão suscitada: reintervenção cirúrgica necessária?
Systolic anterior motion (SAM) is a postoperative complication of mitral valve repair, with an incidence of 5 to 10%. Early recognition of the signs and symptoms of SAM is essential for the management of these patients. This article focuses on the pathophysiology and dynamics of SAM and the treatment strategies described in the literature. The authors present a case study and echocardiographic images illustrating the clinical relevance of the mechanism involved, in order to clarify whether surgical reintervention is necessary.
O SAM resulta da obstrução parcial do tracto de saída do ventrículo esquerdo (LVOT) pelo folheto anterior da válvula mitral1. A sua ocorrência encontra-se descrita em pacientes com miocardiopatia hipertrófica, pós enfarte agudo do miocárdio e no curso pós-operatório de pacientes submetidos a valvuloplastia mitral2,3.
Caso clínicoDescrevemos o caso clínico de uma doente de 71 anos, sexo feminino, de raça caucasiana, internada no nosso serviço devido a insuficiência cardíaca descompensada (NYHA 3/4). Possuía como antecedentes pessoais hipertensão arterial, dislipidémia, fibrilhação auricular crónica, insuficiência mitral grave (prolapso do folheto posterior) e insuficiência tricúspide moderada a grave com hipertensão pulmonar. Fora submetida a cirurgia cardiotorácica 15 dias antes, com valvuloplastia mitral (ressecção quadrangular do folheto posterior com implantação de anel de Carpentier) e anuloplastia tricúspide. O ecocardiograma transesofágico (ETE) pós-operatório revelou boa competência estrutural da válvula mitral e ausência de regurgitação. Sem outras alterações de relevo.
A paciente encontrava-se medicada com furosemida (40+20mg), enalapril 5mg id, carvedilol 6,25mg 2id, amiodarona 200mg id, espironolactona 25mg id, cloreto de potássio retard id, varfarina (INR 2-3), omeprazol 20mg id e sertralina 50mg id.
Na admissão no serviço de urgência apresentava desconforto precordial e sensação de dispneia progressiva para pequenos esforços, bem como ortopneia e dispneia paroxística nocturna. Ao exame objectivo, possuía tensão arterial de 86/64mmHg com uma auscultação cardíaca arrítmica e frequência cardíaca (FC) média de 150bpm, revelando um sopro sistólico no foco aórtico (grau 3/6). A auscultação pulmonar mostrava ausência de murmúrio vesicular na base esquerda. Não apresentava edemas nos membros inferiores.
Analiticamente era de salientar uma anemia normocítica e normocrómica (Hb 10,9g/dl) e agravamento da sua função renal de base (ureia 146mg/dl; creatinina de 1,9mg/dl - Clearance de creatinina (MDRD) de 27,69ml/min). O electrocardiograma revelava um fibrilhação auricular com resposta ventricular média de 150bpm, com má progressão da onda R de V1-V2. A radiografia torácica mostrava a presença de cardiomegália e de moderado derrame pleural esquerdo.
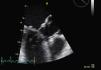
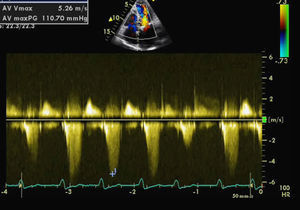
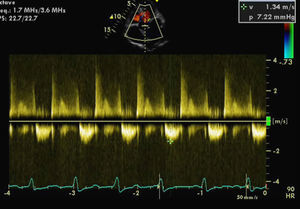
Foi internada para compensação de sua insuficiência cardíaca. O ecocardiograma transtorácico (ECOTT) realizado no primeiro dia de internamento (FC entre 120-150 bpm) (Figura 1) revelou uma válvula aórtica (VAo) fibrosada mas sem limitação da abertura, com insuficiência ligeira.
A Válvula mitral (VM) encontrava-se fibrocalcificada e com hiperecogenicidade do anel; o folheto anterior e o aparelho subvalvular condicionavam obstrução ao tracto de saída do ventrículo esquerdo (VE), originando gradiente intraventricular de 110mmHg com presença de insuficiência moderada e paroxística (em relação provável com a intermitência da gravidade da obstrução do tracto de saída do VE). Aurícula esquerda gravemente dilatada (6,1cm). O VE encontrava-se hipertrofiado com diâmetro diastólico de 4,3cm e com boa função sistólica global. As cavidades direitas possuíam dimensões normais com pressão arterial pulmonar estimada em 40mmHg.
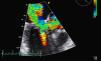
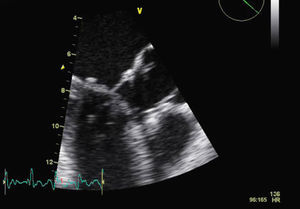
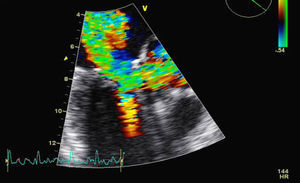
Para melhor esclarecimento da funcionalidade do aparelho valvular mitral, a paciente foi submetida a ETE (FC entre 120-150bpm) (Figuras 2 e 3) que revelou uma VM com anel de Carpentier e folhetos com aspecto degenerativo e redundante, apresentando boa abertura em diástole, mas evidenciando-se movimento anterior sistólico que condicionava obstrução do tracto de saída do ventrículo esquerdo pelo folheto anterior e insuficiência mitral grave (vena contracta=8mm). Vão estruturalmente tricúspide, com boa abertura e insuficiência ligeira. O apêndice auricular esquerdo encontrava-se livre de trombos.
O quadro clínico da paciente revelou-se bastante instável durante o internamento, com manutenção de tensões arteriais sistólicas inferiores a 90mmHg e sinais francos de insuficiência cardíaca NYHA IV, pelo que foi contactado o centro cirúrgico e programada a transferência da doente que ocorreu após 14 dias de internamento, de forma a ser ponderada reintervenção cirúrgica.
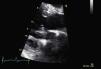
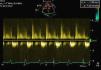
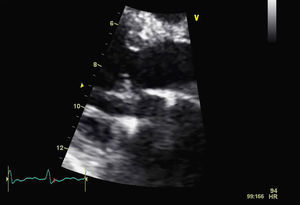
Cerca de um mês e 15 dias após a data do internamento inicial no nosso serviço, a paciente foi observada em consulta externa do nosso hospital, apresentando-se hemodinamicamente estável, com bom estado geral e sem sinais de insuficiência cardíaca. O relatório clínico do centro cirúrgico, onde havia permanecido cerca de 20 dias, revelava não ter sido necessária reintervenção cirúrgica e o ECOTT realizado aquando da alta hospitalar mostrava melhoria significativa dos parâmetros ecocardiográficos (IM ligeira, sem obstrução do tracto de saída do VE pelo folheto anterior da mitral). Foi efectuado um novo ECOTT uma semana após a consulta de reavaliação com FC optimizadas e que revelou uma boa função do aparelho mitral (IM ligeira), sem a presença de obstrução do tracto de saída do VE (Figuras 4 e 5).
A literatura aponta que o SAM resulta da velocidade imposta pelo jacto sanguíneo na câmara de saída do ventrículo esquerdo, exercendo impacto na superfície ventricular do folheto anterior da VM. A posição e as anomalias presentes em ambos os folhetos contribuem para o SAM, sendo reportado em vários estudos fenómeno similar após valvuloplastia3.
Primeiro, existe um encurtamento na distância entre o ponto de coaptação da válvula mitral e o septo. Este fenómeno é causado pelo estiramento do folheto posterior ou pelo alongamento do folheto anterior durante o processo de reparação cirúrgico, causando um aumento na área do folheto anterior da mitral exposta ao fluxo no LVOT4.
Segundo, e ainda durante a reparação cirúrgica dos músculos papilares, a VM poderá ser deslocada anteriormente posicionando-se em torno do LVOT e expondo directamente o folheto anterior ao fluxo do LVOT5–7. Se por um lado a sobrecarga de fluidos no período pré e pós-operatório promove um abaulamento esquerdo do septo limitando o LVOT, por outro, o predomínio de hipovolémia pós operatória causará diminuição do diâmetro diastólico do ventrículo esquerdo diminuindo o diâmetro do LVOT. Deste modo, todas estas condições fisiopatológicas contribuem para o desenvolvimento do SAM, no período pós-operatório da valvuloplastia mitral4.
Existe contudo algum debate acerca do «como» e o «porquê» do folheto anterior da VM ser impulsionado para o LVOT, uma vez que as condições acima descritas estejam presentes8–12. Numa das teorias, o folheto anterior da VM é impulsionado para o LVOT pelo mecanismo de Venturi (Giovanni Venturi, 1746-1822), ocasionado por uma queda de pressão distalmente a uma obstrução. A variação de pressões pode ser restaurada se ocorrer dilatação distalmente à estenose, com um ângulo não superior a 15 graus4. A diminuição brusca de pressões prévia à restrição, promove um fenómeno de sucção na VM em direcção ao LVOT. No âmbito desta teoria foram realizados estudos para medição dos ângulos dos folhetos da VM no ponto de coaptação, tendo sido encontrada uma média de 21 graus, desafiando deste modo o mecanismo descrito13.
Uma outra teoria foi descrita para justificar o fenómeno em discussão: o mecanismo de flow drag. Este pode ser ilustrado «como uma porta aberta no centro de um corredor sob fortes rajadas de vento». O fluxo de ar (mais intenso no centro do corredor) impulsiona a porta em direcção à corrente de ar exercendo deste modo uma pressão numa área progressivamente superior da porta, até que esta finalmente se encerra bruscamente3.
Aplicando esta ilustração na válvula mitral, é possível que o flow drag de sangue passando através do folheto anterior da VM, o puxe para o LVOT onde causaria obstrução. Outros estudos colocam a hipótese de um mecanismo combinado, no qual o fenómeno de Venturi elevaria o folheto em direcção ao septo enquanto o flow drag arrastaria o folheto através deste, encerrando o LVOT14,15.
O diagnóstico de SAMO estudo por ecocardiografia transesofágica ou simplesmente transtorácica é essencial para o diagnóstico de SAM. Estes exames revelarão uma VM com porções residuais pós valvuloplastia que se estendem para além do ponto de coaptação, proeminentes no centro do LVOT. Este estudo demonstrará também um ventrículo pequeno e/ou um abaulamento do septo4. Dependendo do tipo de valvuloplastia, o ponto de coaptação ocorrerá junto ao septo. Pacientes com SAM documentado poder-se-ão apresentar com queixas de dispneia, angina, palpitações, insuficiência cardíaca, sincope, arritmias ou combinação destes sintomas16.
A Gestão e o tratamento do paciente com SAM: reintervenção cirúrgica necessária?A história natural e tratamento de pacientes com SAM após valvuloplastia mitral são um pouco incertos. O grau de SAM estende-se através de um espectro contínuo que envolve uma repercussão minor na VM até à sua forma mais grave, que cursa com a obstrução do LVOT17. Apesar de numerosas técnicas descritas para prevenção deste mecanismo18–21, este continua a ocorrer. A gestão da ocorrência de SAM no bloco operatório permanece controversa, com alguns grupos advogando o tratamento não cirúrgico22,23 e outros propondo uma correcção cirúrgica directa24–26.
A hipervolémia ou hipovolémia podem precipitar a ocorrência de SAM. Deste modo, um paciente submetido a valvuloplastia mitral poderá apresentar-se com um ecotransesofágico inicial normal. De um modo geral os doentes submetidos a cirurgia cardíaca possuem hipovolémia tornando-se esta fulcral no desenvolvimento de SAM hiperdinâmico, na medida em que o efeito Venturi se torna mais pronunciado, resultando na diminuição do volume sistólico efectivo e na diminuição da pressão sanguínea4. Contudo o SAM também se pode manifestar em estados de hipervolémia. O aumento do volume ventricular direito (com aumento das pressões pulmonares), promove um abaulamento do septo interventricular no sentido esquerdo, exacerbando a LVOT. Nessas situações, os nitratos endovenosos devem ser considerados para diminuir as pressões pulmonares de imediato27.
A gestão pós-operatória imediata de um paciente com SAM, consiste em manter o ventrículo esquerdo expandido, permitindo uma razoável abertura do LVOT, tendo neste âmbito as soluções cristalóides ou coloides uma importância fulcral4. A acompanhar este mecanismo fisiopatológico, a FC deve ser estabilizada, maximizando o tempo diastólico. As taquiarritmias diminuem o tempo de enchimento ventricular, condicionando o volume diastólico final, sendo os beta-bloqueadores os fármacos de escolha neste contexto13,16. A infusão contínua é recomendada em detrimento da administração por bólus, uma vez que é mais fácil de titular para obter uma menor FC e a mínima repercussão na tensão arterial4.
O uso de inotrópicos positivos como a epinefrina, com o consequente aumento da FC e contractilidade, devem ser usados com precaução nestes pacientes2. O seu uso afecta adversamente o tempo diastólico ventricular esquerdo promovendo um estado hiperdinâmico, o estreitamento do LVOT e aumentando a severidade do SAM. Desta forma, o objectivo global do tratamento médico do SAM consiste em manter o volume ventricular esquerdo optimizado, o que implica que terapêuticas que diminuam a resistência vascular periférica devam ser evitadas4.
Devido ao facto do SAM se manifestar transitoriamente ou de forma prolongada, o tratamento subsequente deve ser baseado na severidade dos sintomas. Se estes se revelarem incapacitantes ou com agravamento progressivo a reintervenção cirúrgica deverá ser preconizada4, dependendo o tipo de correcção da cirurgia original28.
De Janeiro de 1993 a Dezembro de 2002, Morgan L. Brown et al. (Mayo Clinic – departamento de cirurgia cardiovascular) efectuaram um relevante estudo retrospectivo de todos os doentes em que o SAM ocorrera durante o período intra-operatório, com posterior follow-up17. Fora efectuada valvuloplastia da VM em 2076 pacientes, sendo que em 174 destes (8,4%) foi identificado SAM na ecocardiografia intra-operatória. Inicialmente estes pacientes foram submetidos a tratamento combinado de beta-bloqueantes, vasoconstrição com fenilefrina e/ou expansor do volume intravascular; quatro deles foram submetidos a reparação cirúrgica por persistência do SAM e três a reintervenção cirúrgica tardia por regurgitação de outras causas. O follow-up médio dos restantes 167 pacientes foi de±5,4 anos. Ocorreram duas reintervenções tardias, sendo que nenhuma delas foi causada por SAM ou obstrução do LVOT. Cerca de 90% dos pacientes encontravam-se em classe I da New York Heart Association, 7% em classe II e 3% em classe III ou IV. Foi possível analisar ecocardiogramas de 93 pacientes, sendo que 13 possuíam SAM e 4 demonstravam SAM com obstrução do LVOT.
Nas conclusões deste estudo17 foi enfatizado o facto de que na maioria dos casos de SAM, este fora resolvido com medidas conservadoras (beta-bloqueantes, vasoconstrição e administração de fluidos). O SAM persistente com obstrução do LVOT foi documentado em 2,3% dos pacientes, não tendo estes necessitado de reintervenção tardia. Os outcomes nesta série de doentes (taxa de mortalidade nula e 90% dos pacientes em NYHA I no follow-up) suportam a estratégia não cirúrgica do SAM com ou sem obstrução do LVOT17.
ConclusõesA revisão da literatura efectuada na tentativa de responder a dúvidas suscitadas pelo nosso caso clínico, permitiu-nos concluir que uma reintervenção cirúrgica tardia é rara no tratamento de SAM com obstrução do LVOT pós valvuloplastia mitral, na medida em que este mecanismo melhora com o tempo, com a optimização terapêutica e com o remodeling ventricular a longo prazo. No entanto, pacientes que possuam SAM após valvuloplastia mitral necessitam de follow-up regular, tratamento com beta-bloqueadores e evitar a redução do afterload por fármacos. O uso de beta-bloqueadores não necessita ser eterno. Se a obstrução do LVOT se resolver, a dose destes fármacos poderá ser titulada com estudos ecocardiográficos de três em três meses, sendo que a ausência de obstrução do LVOT permite que o paciente passe a ser reavaliado com estudos temporalmente mais distanciados17.
O SAM torna-se numa causa importante de regurgitação mitral precoce após intervenção cirúrgica da VM, sendo que a optimização do tratamento médico evita que a reintervenção seja necessária17.
De salientar que este fenómeno ocorre em uma variedade de técnicas cirúrgicas, não existindo nenhum anel ou banda, rígida ou flexível que pareça influenciar directamente o prognóstico17.
Em suma, os estudos realizados permitem suportar a estratégia não cirúrgica no tratamento de SAM, na presença ou na ausência de obstrução do LVOT.
Conflito de interessesOs autores declaram não haver conflito de interesses.