A miocardiopatia hipertrófica é uma doença cardíaca hereditária e uma causa major de insuficiência cardíaca e morte súbita. Apesar de descrita há mais de 50 anos, a miocardiopatia hipertrófica sarcomérica ainda não apresenta uma terapêutica farmacológica especifica de doença: os fármacos utilizados por rotina oferecem alívio sintomático mas não previnem ou revertem o fenótipo característico. Os avanços no conhecimento relativo à genética e fisiopatologia da miocardiopatia hipertrófica permitiram, recentemente, descobrir e estudar novas abordagens genéticas e farmacológicas que, ao influenciar diferentes vias envolvidas nesta doença, têm o potencial de funcionar como terapêuticas modificadoras. Estas novas e promissoras terapêuticas são o foco desta revisão.
Hypertrophic cardiomyopathy is an inherited cardiac disease and a major cause of heart failure and sudden death. Even though it was described more than 50 years ago, sarcomeric hypertrophic cardiomyopathy still lacks a disease‐specific treatment. The drugs routinely used alleviate symptoms but do not prevent or revert the phenotype. With recent advances in the knowledge about the genetics and pathophysiology of hypertrophic cardiomyopathy, new genetic and pharmacological approaches have been recently discovered and studied that, by influencing different pathways involved in this disease, have the potential to function as disease‐modifying therapies. These promising new pharmacological and genetic therapies will be the focus of this review.
A miocardiopatia hipertrófica (MCH) é uma doença do miocárdio e uma causa major de morte súbita e insuficiência cardíaca1–8. Define‐se por hipertrofia ventricular esquerda (HVE) não explicada por um aumento da pós‐carga suficiente para causar a alteração observada e é habitualmente detetada por ecocardiografia ou ressonância magnética cardíaca1–8. A prevalência estimada para a doença, com base em dados ecocardiográficos, é de um indivíduo afetado em cada 5009. A prevalência de portadores de mutações genéticas associadas à MCH e com risco de desenvolver a doença é, no entanto, superior a um em cada 200 indivíduos9.
A MCH é, habitualmente, uma doença genética com transmissão autossómica dominante1–8. Encontram‐se atualmente identificadas mais de 1.500 mutações associadas à MCH em mais de 11 genes, sendo que a maioria afeta genes que codificam proteínas do sarcómero, os mais frequentes dos quais o gene codificante da cadeia pesada da β‐miosina (MYH7) e o gene codificante da proteína C ligante da miosina (MYBPC3)1–6.
Histologicamente caracteriza‐se por desorganização da arquitetura miocárdica com desarranjo de cardiomiócitos e das miofibrilhas, aumento da espessura da parede das artérias coronárias intramurais e fibrose intersticial1–6. A hipertrofia habitualmente desenvolve‐se durante os surtos de crescimento, nomeadamente na puberdade e adolescência, e está geralmente presente no início da idade adulta2–5,10. No entanto, algumas mutações poderão levar a expressão hipertrófica da doença mais tardiamente11.
A apresentação clinica é heterogénea e pode iniciar‐se em qualquer fase da vida1,3,5–7. A maioria dos indivíduos sobrevive até idades avançadas com poucos ou nenhuns sintomas1,3,5–7. No entanto, os indivíduos afetados podem desenvolver sintomas e complicações como insuficiência cardíaca, que afeta cerca de 50% dos doentes, fibrilhação auricular, presente em 25% dos pacientes (e que conduz a um risco acrescido de eventos embólicos) e mesmo a ocorrência de morte súbita, a qual, embora tenha uma incidência anual inferior a 1%, pode ser a primeira (e única) manifestação da doença1,3,5–7,9. No entanto, no seu global, a MH sarcomérica é atualmente uma doença relativamente “benigna” em termos de mortalidade (apesar de elevada morbilidade), tendo uma taxa anual de mortalidade cardiovascular de 1‐2%1.
Neste momento, a terapêutica procura o alívio de sintomas e a prevenção de complicações da doença1,3,5–8. Baseia‐se na colocação de cardioversor‐desfibrilhador implantável para prevenção de morte súbita, na terapêutica farmacológica (ou ablação por radiofrequência) para controlo/tratamento de fibrilhação auricular e prevenção de eventos embólicos e no tratamento farmacológico ou invasivo (miectomia cirúrgica ou ablação septal por álcool) para alívio da obstrução do trato de saída do ventrículo esquerdo (VE) nas situações sintomáticas refratárias 1,3,5–8. De salientar que a terapêutica farmacológica para o alívio dos sintomas de insuficiência cardíaca varia caso o doente apresente, ou não, a forma obstrutiva da MCH: na presença de obstrução ou na ausência da mesma, mas com uma fração de ejeção superior a 50%, o tratamento é realizado com β‐bloqueantes, bloqueadores dos canais de cálcio, disopiramida (na forma obstrutiva) e diuréticos; já os doentes com forma não obstrutiva e fração de ejeção reduzida devem ser tratados com β‐bloqueante e um IECA (inibidor da enzima conversora da angiotensina) ou ARA (antagonista do recetor da angiotensina) e, eventualmente, diuréticos e ARM (antagonista dos recetores dos mineralocorticoides)1. Doentes com progressiva disfunção cardíaca poderão ainda ser candidatos a transplante cardíaco1,3,5–8.
Apesar de a descrição moderna da MCH ter mais de 50 anos, as terapêuticas com base na evidência científica são escassas, havendo poucos estudos clínicos (e envolvendo pequeno número de doentes) de avaliação da eficácia de tratamentos farmacológicos nesta patologia 7,8,12–14. Nas últimas décadas, o avançar dos conhecimentos sobre a fisiopatologia da MCH abriu as portas para a descoberta de novas terapêuticas com o potencial de intervir na fisiopatologia complexa da MCH, alterar a sua história natural e funcionar como terapêutica modificadora de doença7,8,12–14. Indivíduos portadores de mutações associadas à MCH mas ainda sem expressão fenotípica (indivíduos genótipo positivos‐fenótipo negativos) são uma população de especial interesse, uma vez que apresentam o potencial para a prevenção do desenvolvimento fenotípico da doença.
Esta revisão tem como objetivo discutir os mais recentes dados e desenvolvimentos sobre estas novas perspetivas terapêuticas na abordagem da MCH.
Novas perspetivas terapêuticas na MCHDiltiazemO diltiazem é um bloqueador não di‐hidropiridínico dos canais de Ca2+ tipo L indicado como terapêutica de segunda linha para alívio sintomático no contexto de MCH, dada a sua menor eficácia comparativamente com β‐bloqueantes1,3,5–8. Pode ainda ser utilizado para controlo da resposta ventricular em doentes com fibrilhação auricular1,3,5–8.
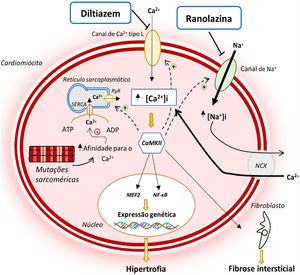
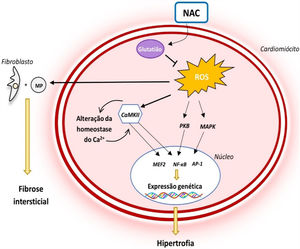
Atualmente, reconhece‐se que as mutações sarcoméricas associadas à MCH conduzem a uma desregulação precoce da homeostase intracelular do Ca2+12,14–16 (Figura 1). Tal alteração deve‐se ao facto de estas mutações aumentarem a sensibilidade/afinidade dos miofilamentos sarcoméricos para com este ião, impedindo a sua recaptação para o retículo sarcoplasmático ou expulsão para o exterior do cardiomiócito na diástole12,14–18. Adicionalmente, as mutações sarcoméricas conduzem a um aumento do gasto energético no cardiomiócito, diminuindo a ATP (adenosina trifosfato) disponível para o funcionamento de bombas iónicas que regulam os níveis intracelulares de Ca2+12,14–16 (Figura 2). Esta desregulação conduz à acumulação intracelular de Ca2+ que, para além de impedir o relaxamento celular, levar a disfunção diastólica e aumentar o risco arrítmico, ativa vias sinalizadoras que contribuem para a remodelação miocárdica adversa que caracteriza a MCH12,14–16 (Figura 1)
Alterações na homeostase do Ca2+ e na INaL na MCH e modo de atuação do diltiazem e ranolazina12,14,21
Legenda: ATP‐ adenosina trifosfato; ADP‐ adenosina monofosfato; CaMKII‐ proteína cinase II Ca2+/calmodulina dependente; INaL‐ corrente tardia de sódio; MEF2‐ fator 2 ativador do miócito; NCX‐ permutador sódio/cálcio; NF‐κB‐ fator de transcrição nuclear kappa B; SERCA‐ ATPase de Ca2+ sarco‐endoplasmática; RyR‐ recetor de rianodina.
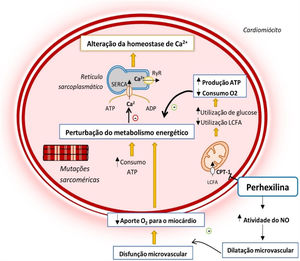
Alterações do metabolismo energético do cardiomiócito na MCH e mecanismo de ação da perhexilina12,14,24
Legenda: ADP‐ adenosina difosfato; ATP‐ adenosina trifosfato; CPT‐1‐ carnitina‐palmitoil transferase 1; LCFA‐ ácidos gordos de cadeia longa; NO‐ Monóxido de azoto; RyR‐ recetor de rianodina; SERCA‐ ATPase de Ca2+ sarco‐endoplasmática.
Estudos em modelos animais da MCH sugerem que o tratamento com bloqueadores dos canais de Ca2+, ao diminuir a entrada de cálcio na célula, pode corrigir a desregulação da homeostase deste ião: em ratinhos transgénicos portadores da mutação R403Q no gene Myh6 comprovou‐se a existência de uma diminuição dos níveis de Ca2+ e das respetivas proteínas de armazenamento deste ião no reticulo sarcoplasmático, diminuição essa que antecede o desenvolvimento de alterações na morfologia e histologia miocárdica típica da MCH17. O tratamento com diltiazem corrigiu estas alterações na homeostase do Ca2+ e preveniu o desenvolvimento de HVE e fibrose intersticial nos ratinhos do estudo17. Foi mais tarde comprovado que o tratamento com diltiazem prevenia ainda o desenvolvimento de disfunção diastólica e morte súbita em ratinhos portadores da mutação I79N no gene codificador da troponina T19.
Perante estes resultados, foi proposto o uso do diltiazem como fármaco modificador de doença em indivíduos portadores de mutações associadas à MCH que não apresentam ainda HVE8,13. Num ensaio clínico piloto, aleatorizado e controlado por placebo, duplamente oculto, com uma amostra de 38 portadores de mutações sarcoméricas sem HVE, o diltiazem (360mg/dia durante 25 meses) não reduziu a espessura máxima da parede do VE mas demonstrou estabilizar o diâmetro telediastólico do VE e, consequentemente, o rácio diâmetro telediastólico do VE‐espessura da parede do VE, comparativamente com o grupo de controlo, no qual houve uma diminuição deste parâmetro ao longo do estudo16. Adicionalmente, a magnitude do efeito benéfico do fármaco aparentou depender da mutação sarcomérica específica, sendo mais marcado em indivíduos com mutações no gene MYBPC316. Uma vez que a MCH se associa a uma diminuição das dimensões da cavidade do VE, a estabilização do diâmetro telediastólico desta cavidade pelo diltiazem sugere um efeito benéfico do fármaco na história natural da doença16. O diltiazem poderá, assim, ser útil na prevenção da expressão fenotípica da MCH em indivíduos geneticamente predispostos16. No entanto, a pequena amostra e o follow‐up limitado dos participantes são limitações importantes deste estudo16.
Inibidores da corrente tardia de sódioOs inibidores da INaL (corrente tardia de sódio) incluem agentes como a ranolazina, fármaco que pode ser utilizado como terapêutica de segunda linha para o alívio de sintomas e melhoria da capacidade funcional em pacientes com doença coronária estável.
A perturbação da homeostase intracelular do Na+ pode contribuir para a fisiopatologia da MCH13,20,21, uma vez que níveis elevados de Na+ no cardiomiócito agravam a desregulação da homeostase intracelular do Ca2+, que, como já foi referido, constitui um evento essencial na patogenia desta doença12,14–16 (Figura 1).
Um recente estudo em cardiomiócitos e trabéculas isolados do septo interventricular de doentes com MCH identificou um aumento da amplitude da INaL nestas células e, consequentemente, uma subida dos níveis intracelulares do Na+20. Esta alteração, por sua vez, conduz a um aumento da entrada de Ca2+ na célula através do NCX (permutador sódio‐cálcio), elevando os níveis intracelulares do Ca2+21. A inibição da INaL pela ranolazina demonstrou reduzir os níveis intracelulares de sódio e, consequentemente, diminuir a entrada de Ca2+ e restabelecer a sua homeostase no cardiomiócito21 (Figura 1). Em conjunto, estes efeitos reduziram o risco de arritmias e melhoraram a função diastólica21. Em longo prazo, é expectável que possam também diminuir a ativação de vias sinalizadoras que conduzem a uma remodelação adversa no miocárdio, com implicações na progressão da doença21.
Deste modo, foi considerado que a ranolazina teria o potencial teórico de modificar a história natural desta doença ou permitir alívio sintomático. Esta hipótese serviu de base para o estudo RESTYLE‐HCM (Ranolazine in patients with symptomatic hypertrophic cardiomyopathy), que procurou avaliar os efeitos benéficos da ranolazina na capacidade funcional de pacientes com MCH22. Neste ensaio clínico duplamente oculto, aleatorizado e controlado por placebo, com uma amostra de 80 indivíduos com MCH sintomática, a ranolazina, apesar de reduzir o risco arrítmico, não melhorou significativamente a função diastólica do VE, tolerância ao esforço, qualidade de vida ou os níveis plasmáticos de péptido natriurético de tipo B (NT‐proBNP)22.
Outro estudo denominado LIBERTY‐HCM (Effect of Eleclazine (GS‐6615) on Exercise Capacity in Subjects With Symptomatic Hypertrophic Cardiomyopathy) procurou avaliar o efeito de um inibidor mais potente da INaL, a eleclazina, na melhoria da tolerância ao esforço em pacientes com MCH23. Este ensaio foi, no entanto, terminado prematuramente devido aos efeitos adversos que o fármaco apresentou num estudo paralelo em pacientes com cardiopatia isquémica23.
Moduladores metabólicosA perhexilina é um modulador metabólico que pode ser utilizado para o alívio da precordialgia refratária no contexto de cardiopatia isquémica24–27. Apresenta como principal mecanismo de ação uma potente inibição da CPT‐1 (carnitina‐palmitoil transferase‐1) e, em menor grau, da CPT‐2 (carnitina‐palmitoil transferase‐2)24–26. É um agente farmacologicamente complexo, com potencial para neurotoxicidade e/ou hepatotoxicidade, sendo assim necessária uma monitoração em longo prazo do seu nível sérico24–26.
As CPT‐1/CPT‐2 são enzimas‐chave para o transporte mitocondrial de ácidos gordos de cadeia longa24–27. A sua inibição pela perhexilina induz uma alteração no metabolismo celular, reduzindo o consumo de ácidos gordos e favorecendo o uso de hidratos de carbono como substrato metabólico, o que se associa a uma maior eficiência na utilização de oxigénio para a produção de ATP no miocárdio24–26 (Figura 2). Adicionalmente, o fármaco potencia a atividade do monóxido de azoto, o que permite um maior aporte de oxigénio para o miocárdio24 (Figura 2).
A importância deste efeito da perhexilina na MCH deve‐se ao facto de as mutações sarcoméricas associadas à doença conduzirem a um aumento da formação de pontes cruzadas e gasto energético durante a contração do cardiomiócito, o que leva a uma ineficiente utilização de ATP12,14,18,23 (Figura 2). Estas alterações conduzem a uma perturbação do metabolismo energético do miocárdio que se reflete numa diminuição do rácio fosfocreatina:ATP, um bom indicador do estado energético do músculo cardíaco12,14,18,26,28. Esta perturbação antecede o desenvolvimento de HVE, sugerindo que a perturbação do metabolismo energético do miocárdio desempenha um papel primário na fisiopatologia da doença28.
Adicionalmente, a MCH associa‐se a uma disfunção microvascular com diminuição da resposta vasodilatadora e aporte de oxigénio para o miocárdio, o que exacerba a perturbação energética primária29 (Figura 2). Uma vez que a perhexilina potencia a atividade do monóxido de azoto, este fármaco tem a capacidade adicional de aliviar a disfunção microvascular que acompanha a doença14,24,29 (Figura 2).
Deste modo, a perhexilina poderá ser útil na abordagem da MHC (Figura 2). Para testar esta hipótese, foi realizado um ensaio clínico duplamente oculto, aleatorizado e controlado, com uma amostra de 46 doentes com MCH sintomática29. Neste ensaio, a administração de perhexilina conduziu a uma melhoria do estado energético do miocárdio, evidenciada por um aumento do rácio fosfocreatina:ATP no músculo cardíaco29. Este aumento associou‐se a uma melhoria da sintomatologia, consumo de O2 e função diastólica dos doentes29.
Apesar destes resultados iniciais promissores, um recente ensaio clínico, com uma amostra de 35 indivíduos com MCH obstrutiva, foi terminado precocemente perante a ausência de eficácia demonstrável da perhexilina na melhoria da sintomatologia e consumo de O2 em doentes com MCH (https://clinicaltrials.gov/ct2/show/study/NCT02862600). Outro ensaio clínico, que procuraria avaliar a eficácia da perhexilina na melhoria da capacidade funcional de doentes com MCH, foi também cancelado previamente ao início do recrutamento de pacientes, dada a ausência de eficácia demonstrável no ensaio atrás referido (https://clinicaltrials.gov/ct2/show/NCT02431221).
Muito recentemente foi estudado outro modulador metabólico, a trimetazidina, na MCH30. Este fármaco, ao inibir a β‐oxidação de ácidos gordos, apresenta também potenciais efeitos benéficos no metabolismo energético dos cardiomiócitos30. No entanto, num recente ensaio clínico, duplamente oculto, aleatorizado e controlado por placebo, a trimetazidina não apresentou benefícios na melhoria do consumo máximo de O2 ou na distância percorrida aos seis minutos em doentes com MCH não obstrutiva sintomática30.
Estes resultados globalmente não mostraram eficácia destes moduladores metabólicos na melhoria sintomática de doentes com MCH, apesar dos seus efeitos benéficos teóricos na fisiopatologia da doença. Não se encontram atualmente em curso outros ensaios relativos ao uso destes fármacos, tendo o interesse sobre os mesmos diminuído perante os resultados desapontantes nos estudos referidos.
Ainda assim, encontra‐se em fase de recrutamento um pequeno ensaio clínico piloto, de fase 1, que procurará avaliar o efeito do nitrato de sódio na melhoria do estado energético (rácio fosfocreatina/ATP) no miocárdio, em doentes com MCH (https://clinicaltrials.gov/ct2/show/NCT03251287).
N‐acetilcisteínaA n‐acetilcisteína (NAC) é um fármaco conhecido pelo seu uso na intoxicação farmacológica por acetaminofeno31. Fornece o grupo cisteína necessário para restabelecer os níveis intracelulares de glutatião, um importante antioxidante celular31,32.
Reconhece‐se que há um aumento dos níveis de espécies reativas de oxigénio na MCH e que o stress oxidativo desempenha um papel importante na fisiopatologia da doença (Figura 3): estudos em coelhos com a mutação R403Q no gene codificante da cadeia pesada da β‐miosina identificaram que o desenvolvimento de HVE e fibrose miocárdica se acompanha de um aumento dos níveis de vários marcadores de stress oxidativo33. O stress oxidativo contribui para o fenótipo da MCH ao estimular a atividade de ativar cinases e fatores de transcrição indutores de hipertrofia34. Adicionalmente, promove a proliferação de fibroblastos e a atividade de metaloproteínases, o que favorece a fibrose intersticial e remodelação da matriz extracelular35. O stress oxidativo promove ainda a apoptose de cardiomiócitos, contribuindo para a disfunção celular e remodelação miocárdica34 (Figura 3).
Papel do stress oxidativo na fisiopatologia da MCH e mecanismo de ação da NAC14,34
Legenda: AP‐1‐ proteína ativadora‐1; CaMKII‐ proteína cinase II Ca2+/calmodulina dependente; NF‐κB‐ fator de transcrição nuclear kappa B; PKB‐ proteína cinase B; ROS‐ espécies reativas de oxigénio.
Deste modo, o efeito antioxidante da NAC poderá desempenhar um papel importante no tratamento da MCH (Figura 3). Estudos em modelos animais da MCH (ratinhos com a mutação R92Q no gene codificante da troponina T) identificaram que este fármaco reduz os níveis de stress oxidativo e colagénio intersticial no miocárdio, revertendo parcialmente a fibrose estabelecida35. Adicionalmente, demonstrou‐se que a NAC restabelece as reservas intracelulares de glutatião, reverte a HVE e fibrose intersticial já estabelecida, corrige a disfunção sistólica e reduz o risco arritmogénico em coelhos portadores da mutação R403Q no gene codificante da cadeia pesada da β‐miosina32.
Estes resultados promissores estiveram na base da realização do estudo HALT‐HCM (Hypertrophy Regression With N‐Acetylcysteine in Hypertrophic Cardiomyopathy), um recente ensaio clínico piloto, duplamente oculto, aleatorizado e controlado por placebo, que procurou avaliar o efeito da NAC na reversão da HVE e fibrose intersticial na MCH36. Neste ensaio, a terapêutica com NAC apresentou um efeito benéfico relativamente desapontante nos índices de HVE e fibrose miocárdica36. A pequena amostra do estudo impede, no entanto, a tomada de conclusões firmes sobre a eficácia da NAC na MCH36.
EstatinasAs estatinas são inibidores da HMG‐CoA (3‐hidroxi‐3‐metilglutaril coenzima A) redutase, enzima essencial para a biossíntese do colesterol33,37–40. Habitualmente prescritos para o tratamento da dislipidémia, são fármacos com uma grande variedade de ações biológicas para lá do seu efeito nos níveis de colesterol33,37–40. São assim agentes com efeitos pleiotrópicos, desempenhando ações ao nível do stress oxidativo, proliferação celular, função endotelial, coagulação e modulação imunitária33,37–40.
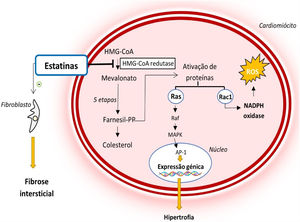
Dados estes efeitos biológicos, as estatinas têm o potencial de desempenhar ações benéficas em patologias como a MCH37,39 (Figura 4). Ao inibirem a HMG‐CoA redutase, reduzem a ativação de múltiplas moléculas sinalizadoras que promovem a hipertrofia e fibrose intersticial cardíaca33,39–41. Adicionalmente, reduzem o stress oxidativo ao diminuir a produção de espécies reativas de oxigénio mediada pela Rac1, fator que contribui para o desenvolvimento de HVE e fibrose intersticial (Figura 4)33,39–41.
Mecanismo de ação das estatinas e o seu papel na fisiopatologia da MCH39,40
Legenda: Ap‐1‐ proteína ativadora‐1; Farnesil‐PP‐ farnesil‐pirofosfato; HMG‐CoA‐ 3‐hidroxi‐3‐metilglutaril coenzima A; MAPK‐ proteína cinase ativada por mitogénio; NADPH‐ nicotinamida‐adenina‐dinucleótido‐fosfato reduzida; ROS‐ espécies reativas de oxigénio.
Em estudos em modelos animais da MCH (coelhos com a mutação R403Q no gene codificante da cadeia pesada da β‐miosina) com HVE estabelecida, a sinvastatina melhorou a função diastólica e reduziu a espessura da parede do VE e os níveis de colagénio intersticial, revertendo assim a hipertrofia e fibrose cardíaca38. Outro estudo, no mesmo modelo animal da MCH, demonstrou que a administração de atorvastatina previamente ao desenvolvimento de HVE reduz o stress oxidativo miocárdico e previne o desenvolvimento de HVE33.
Em contraste com estes resultados, os estudos em humanos não demonstraram um efeito benéfico das estatinas na regressão do fenótipo da MCH: num ensaio clínico piloto duplamente oculto, aleatorizado e controlado por placebo, com uma amostra de 28 indivíduos com MCH e HVE estabelecida, o tratamento com atorvastatina não se associou a uma diminuição da massa ventricular esquerda ou melhoria da função diastólica42. Estes resultados foram reproduzidos num outro ensaio clínico com uma amostra inicial de 21 doentes no qual a atorvastatina não conduziu a uma regressão da HVE41.
Um terceiro estudo, o SIRCAT (Statin Induced Regression of Cardiomyopathy Trial), procurou novamente avaliar o potencial da atorvastatina na reversão da HVE em doentes com MCH43. Neste ensaio clínico, aleatorizado e controlado por placebo, a atorvastatina não demonstrou reduzir a massa do VE comparativamente com o placebo43.
A pequena amostra destes ensaios – associada à existência de múltiplas mutações e vias fisiopatológicas envolvidas na MCH em humanos, ao contrário do que ocorre nos modelos animais previamente estudados, nos quais era constante a mutação na cadeia pesada da β‐miosina – poderá explicar as discordâncias entre os resultados destes ensaios clínicos e os dados experimentais obtidos em modelos animais. No entanto, já foram concluídos três ensaios clínicos com a atorvastatina na MCH, sendo que nenhum revelou benefício deste fármaco na reversão fenotípica da MCH. Torna‐se pouco provável, portanto, que este fármaco possa funcionar como terapêutica modificadora de doença na MCH. Ainda assim, não é possível excluir que outras estatinas possam ser eficazes na prevenção ou reversão da HVE e fibrose intersticial.
Inibidores do SRAAOs inibidores do SRAA, como os IECA, ARA e ARM, são agentes que podem ser utilizados, em adição aos β‐bloqueantes, para o tratamento da MCH associada a insuficiência cardíaca com fração de ejeção inferior a 50% e sem obstrução no trato de saída do VE1.
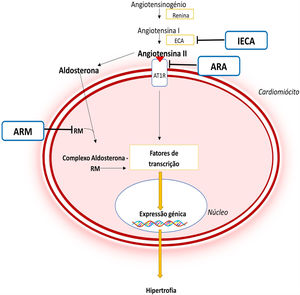
À semelhança de outras patologias, como a hipertensão arterial, na qual a angiotensina II e a aldosterona conduzem a uma remodelação cardíaca e vascular adversa, atualmente reconhece‐se que a ativação do SRAA pode desempenhar um papel importante na fisiopatologia da MCH8,44–46 (Figura 5). Este eixo contribui para o desenvolvimento de HVE e fibrose miocárdica através de efeitos pró‐fibróticos e pró‐hipertróficos mediados pela angiotensina II em circulação e pela ativação local deste sistema no miocárdio44–46. Adicionalmente, foi demonstrado que polimorfismos nos genes que codificam a enzima conversora da angiotensina ou o recetor AT1da angiotensina II podem conduzir a um maior grau de HVE em doentes com MCH45.
Importância do SRAA na fisiopatologia da MCH e mecanismo de ação dos diferentes fármacos inibidores deste sistema44,45
Legenda: ARA‐ antagonista do recetor da angiotensina; ARM‐ antagonista do recetor dos mineralocorticóides; AT1R‐ recetor tipo 1da angiotensina II; CaMKII‐ proteína cinase II Ca2+/calmodulina dependente; ECA‐ enzima conversora da angiotensina; IECA‐ inibidor da enzima conversora da angiotensina; JAK‐ Cinase Janus; MEF2‐ fator 2 ativador do miócito; NF‐κB‐ fator de transcrição nuclear kappa B; RM‐ recetor de mineralocorticóides; STAT‐ transdutor de sinal e ativador da transcrição.
Deste modo, a inibição farmacológica do SRAA poderá contribuir para a prevenção ou reversão do fenótipo da MCH7,8 (Figura 5). Estudos em ratinhos com a mutação R92Q na troponina T demonstraram que o losartan, um ARA II, reduz os níveis de TGF β‐1 (fator de crescimento transformador β‐1), um mediador pró‐fibrótico da angiotensina II, e diminui os níveis de colagénio intersticial no coração deste modelo animal47. A antagonização dos recetores de mineralocorticoides pela espironolactona também demonstrou ser eficaz na reversão da fibrose intersticial e desarranjo de cardiomiócitos no mesmo modelo animal, melhorando ainda a função diastólica44. Um estudo num outro modelo animal de MCH (ratos consómicos SS‐16BN/Mcwi formados pela substituição de um cromossoma de uma estirpe de rato no genoma de outra estirpe de rato) comprovou que o tratamento com captopril, um IECA, reduziu a HVE desenvolvida48. A terapêutica combinada de captopril com espironolactona permitiu ainda uma redução mais significativa da espessura da parede do VE comparativamente com a monoterapia com captopril48.
Os primeiros estudos em humanos também apresentaram resultados promissores. A administração de valsartan (ARA II) num estudo aleatorizado, não controlado por placebo, com uma amostra de 23 indivíduos com MCH, reduziu a síntese de colagénio tipo I, um dos principais tipos de colagénio no miocárdio49. Em outro ensaio clínico piloto, não controlado e não aleatorizado, o losartan, em adição à terapêutica habitual dos doentes, associou‐se a uma redução da sintomatologia, melhoria da função diastólica do VE e diminuição dos níveis de NT‐proBNP50.
Estes primeiros ensaios não demonstraram que os ARA II revertessem a HVE estabelecida em humanos49,50. Estudos mais recentes, no entanto, sugerem que estes fármacos possam apresentar esse efeito benéfico: num ensaio clínico piloto, duplamente oculto, aleatorizado, não controlado por placebo, o losartan conduziu a uma ligeira redução da massa ventricular esquerda51. Este efeito foi reproduzido num outro estudo, aleatorizado e controlado por placebo, com uma amostra semelhante de 20 doentes com MCH52. Neste estudo, o losartan, adicionalmente, reduziu o grau de fibrose intersticial miocárdica evidenciada por uma diminuição da extensão do realce tardio com gadolínio na ressonância magnética cardíaca52.
Num terceiro ensaio clínico, duplamente oculto, aleatorizado e controlado por placebo, com uma amostra de 24 indivíduos com MCH e HVE, o candesartan (ARA II) também reverteu a HVE e conduziu ainda a uma melhoria de os parâmetros ecográficos de função ventricular, a sintomatologia e tolerância ao exercício dos doentes53. Neste estudo, a magnitude do efeito benéfico do fármaco dependeu da mutação sarcomérica especifica que o doente apresentava, sendo mais marcada em indivíduos com mutações no gene MYH753.
Para esclarecer os resultados contraditórios obtidos nestes ensaios clínicos e determinar a eficácia da inibição do SRAA na reversão da HVE e fibrose intersticial na MCH, foi realizado o estudo INHERIT (Inhibition of the Renin Angiotensin System With Losartan in Patients With Hypertrophic Cardiomyopathy)54. Neste ensaio aleatorizado, duplamente oculto e controlado por placebo, com uma amostra de 124 doentes, o tratamento com losartan, apesar de seguro, não reduziu significativamente a massa ventricular esquerda nem a fibrose intersticial54. Estes resultados não apoiam, assim, a hipótese de que este agente consiga alterar o fenótipo da MCH em indivíduos com doença estabelecida54.
No entanto, ainda existe a possibilidade de que a inibição do SRAA seja útil em doentes com MCH pré‐clínica (indivíduos genótipo positivos‐fenótipo negativos) na prevenção do desenvolvimento da doença54. Encontra‐se a decorrer o estudo VANISH (Valsartan for Attenuating Disease Evolution In Early Sarcomeric HCM), um ensaio clínico com uma amostra desejada de 150 indivíduos portadores de mutações associadas à MCH mas ainda sem HVE, que procurará avaliar a eficácia da terapêutica com valsartan na prevenção da expressão fenotípica desta patologia7,23.
Adicionalmente, encontra‐se em curso um ensaio clínico que procurará avaliar o efeito da espironolactona na redução da fibrose miocárdica, avaliada através do realce tardio por gadolínio na ressonância magnética (https://clinicaltrials.gov/ct2/show/NCT02948998)
Moduladores da contratilidade do sarcómeroA miosina é uma das proteínas que fazem parte do complexo contrátil do sarcómero55. Constitui uma enzima com atividade de ATPase que interage ciclicamente com os filamentos de actina para converter energia em força e permitir a contração do cardiomiócito55.
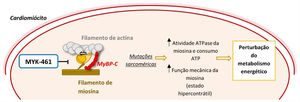
Como previamente referido, a MCH é maioritariamente causada por mutações em proteínas do sarcómero, sendo as mais frequentes as mutações nos genes MYH7 e MYBPC31–6. Foi demonstrado que mutações no gene MYH7 conduzem a um estado de hipercontractilidade ao aumentarem a atividade ATPase e função mecânica (produção de força e movimento) da miosina cardíaca55. Este ganho de função conduz a um aumento do consumo de ATP, contribuindo para a perturbação do metabolismo energético que promove o desenvolvimento da doença18,55 (Figura 6).
Mecanismo de ação de um inibidor alostérico da miosina (MYK‐461) e a sua importância na fisiopatologia da MCH55,56
Legenda: ATP‐ adenosina trifosfato; MyBP‐C‐ proteína C ligante da miosina.
Deste modo, moléculas com a capacidade para reduzir este aumento de atividade da miosina poderão prevenir o desenvolvimento da MCH. Para testar esta hipótese, foi recentemente desenvolvido o MYK‐461 (também conhecido por Mavacamtem), um inibidor alostérico da miosina que reduz a sua atividade de ATPase e, consequentemente, a produção de força e contratilidade do sarcómero56 (Figura 6). A administração da MYK‐461/Mavacamtem em modelos animais da MCH preveniu o desenvolvimento de HVE em ratinhos pré‐hipertróficos e reverteu parcialmente a hipertrofia em ratinhos com o fenótipo estabelecido55. Histopatologicamente, esta molécula preveniu (mas não reverteu) o desenvolvimento de fibrose miocárdica e desarranjo de cardiomiócitos56. Adicionalmente, reduziu a expressão de genes pró‐fibróticos e pró‐hipertróficos56.
A segurança do MYK‐461 já foi demonstrada em pequenos ensaios clínicos de fase 1 em indivíduos normais e com MCH estabelecida23. Foi recentemente concluído o estudo PIONEER‐HCM (A Phase 2 Open‐label Pilot Study Evaluating MYK‐461 in Subjects With Symptomatic Hypertrophic Cardiomyopathy and Left Ventricular Outflow Tract Obstruction), um ensaio com uma amostra de 21 pacientes com MCH obstrutiva estabelecida que demonstrou que a terapêutica com MYK‐461/Mavacamtem, no subgrupo de pacientes submetidos à dose mais elevada do fármaco (os resultados no outro subgrupo ainda não foram publicados), reduz significativamente o gradiente máximo no trato de saída do VE pós‐exercício e melhora o consumo máximo de O223.
Adicionalmente, está em curso o estudo MAVERICK‐HCM (A Phase 2 Study of Mavacamten in Adults With Symptomatic Non‐Obstructive Hypertrophic Cardiomyopathy), que procurará avaliar a segurança e tolerância da terapêutica com MYK‐461/Mavacamtem em doentes com MCH não obstrutiva, bem como o estudo EXPLORER‐HCM (Clinical Study to Evaluate Mavacamten (MYK‐461) in Adults With Symptomatic Obstructive Hypertrophic Cardiomyopathy), um ensaio com uma amostra desejada de 250 pacientes, que procurará avaliar o efeito do MYK‐461/ Mavacamtem no consumo máximo de O2 em pacientes com MCH obstrutiva23.
Terapêutica genéticaA terapêutica genética é uma estratégia com o potencial de prevenir o desenvolvimento da doença14,57.
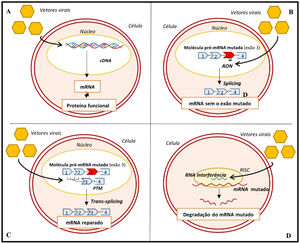
Recentemente, procurou‐se corrigir a MCH ao induzir a expressão de uma proteína sarcomérica funcional que substituísse a forma endógena, e mutada, da proteína14,57 (Figura 7A). Esta estratégia tem especial interesse em mutações no gene MYBPC3, que se associam a níveis baixos da proteína sarcomérica (haploinsuficiência)14,57. Num recente estudo, a transferência, através de vetores virais, de cDNA (ácido desoxirribonucleico complementar) wild‐type do gene Mybpc3 em ratinhos com uma mutação neste gene permitiu aumentar, de forma dose‐depende, os níveis de mRNA (ácido ribonucleico mensageiro) e de proteína C ligante da miosina wild‐type58. Conseguiu ainda suprimir os níveis de mRNA mutante e permitiu prevenir em longo prazo o desenvolvimento de HVE e disfunção sistólica e diastólica58. Em concordância com estes resultados, outro estudo demonstrou que cardiomiócitos com uma mutação no gene MYBPC3, derivados de células estaminais pluripotentes induzidas e isoladas a partir de um paciente com MCH, apresentam hipertrofia e níveis reduzidos de proteína C ligante da miosina59. Neste estudo, a transferência de cDNAMYBPC3wild‐type aumentou os níveis desta proteína, o que reverteu a hipertrofia dos cardiomiócitos59.
Abordagens genéticas para o tratamento da MCH. A‐ gene transfer; B‐ skipping de exões; C‐ técnica SMaRT; D‐ silenciamento alélico com RNAi57,63,64
Legenda: AON‐ oligonucleotidos antissense; cDNA‐ ácido desoxirribonucleico complementar; mRNA‐ ácido ribonucleico messangeiro; PTM‐ molécula pré‐trans‐splicing; RISC‐ complexo silenciador induzido por ácido ribonucleico.
Outras abordagens, igualmente promissoras, procuram atuar ao nível do mRNA alterado. Uma destas abordagens consiste no skipping de exões, uma técnica que recorre à administração de oligonucleótidos antissense através de vetores virais14,57,60,61 (Figura 7B). Estes oligonucleótidos, ao serem complementares a uma determinada região de interesse no pré‐mRNA, impedem a ligação de proteínas reguladoras do splicing nessa região e inibem a inclusão de exões‐alvo no mRNA maturo14,57,60,61. Uma recente prova‐de‐conceito demonstrou que a utilização desta técnica em ratinhos com mutações no gene Mybpc3, para remoção do exão onde se encontrava a mutação, permitiu aumentar os níveis de uma isoforma forma funcional da proteína C ligante da miosina60. Adicionalmente, preveniu o desenvolvimento de disfunção sistólica e HVE nestes ratinhos, embora este efeito tenha sido transitório60.
Outra estratégia consiste em reparar o pré‐mRNA alterado através da técnica SMaRT (Trans‐splicing de RNA mediado por spliceossoma)14,57,61‐63 (Figura 7C). Nesta técnica, duas moléculas – a molécula mutante de pré‐mRNA e uma molécula terapêutica, entregue à célula através de um vetor viral – sofrem splicing entre si para originar uma molécula reparada de mRNA57,62,63. Em modelos animais com mutação no gene Mybpc3, a técnica SMaRT demonstrou corrigir o mRNA alterado mas não se associou a um aumento significativo dos níveis de proteína normal ou à prevenção do fenótipo da MCH64. A baixa eficiência da técnica SMaRT foi também demonstrada num estudo em cardiomiócitos derivados de células estaminais pluripotentes induzidas59.
Outra estratégia consiste na administração de RNAi (ácido ribonucleico de interferência), através de vetores virais para silenciar as mutações associadas à MCH14,63. Num estudo em ratinhos com uma mutação no gene Myh6 esta técnica demonstrou ser capaz de prevenir o desenvolvimento do fenótipo da doença65 (Figura 7D).
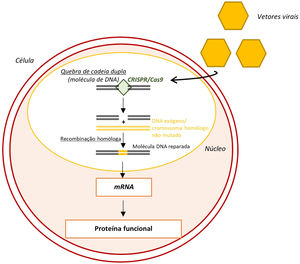
Por fim, outra abordagem corresponde à edição do genoma através do sistema CRISPR/Cas9 (clustered regularly interspaced short palindromic repeats/CRISPR associated protein 9)63. Este sistema, ao funcionar como uma nuclease, tem a capacidade de induzir quebras de cadeia‐dupla (Figura 8)63. Estas quebras serão de seguida reparadas por mecanismos moleculares endógenos, preferencialmente mecanismos de recombinação homóloga que permitem a correção do alelo mutante sem induzir novas mutações indesejadas63.
Edição do genoma através do sistema CRISPR‐Cas963
Legenda: CRISPR‐Cas9‐ clustered regularly interspaced short palindromic repeats/ CRISPR associated protein 9; mRNA‐ ácido ribonucleico messangeiro.
Um recente estudo procurou corrigir a mutação no gene MYBPC3 em células estaminais e embriões humanos através do CRISPR/Cas966. Neste estudo, a eficiência da edição do genoma foi muito superior em embriões comparativamente com células estaminais66. Em embriões esta correção foi frequentemente feita por mecanismos de recombinação homóloga (com recurso ao cromossoma homólogo não mutado) o que, como referido, comporta um menor risco de indução de novas mutações66. Estes resultados não se associaram a efeitos em genes indesejados ou alterações do desenvolvimento embrionário induzidas pela CRISPR/Cas9 e, através da modulação da fase do ciclo celular em que a quebra de cadeia‐dupla foi induzida, foi possível evitar a criação de mosaicismos66. Esta elevada eficácia na edição do genoma e ausência de efeitos adversos sugere que o sistema CRISPR/Cas9 tem o potencial para corrigir mutações hereditárias em embriões humanos66.
ConclusãoApesar de há algumas décadas ser considerada uma doença rara, hoje se reconhece que a MCH é uma patologia relativamente comum, com possíveis consequências nefastas para os indivíduos afetados. Ainda assim, o seu tratamento pouco se alterou desde que a MCH foi inicialmente descrita, sendo que a procura de abordagens capazes de reverter ou prevenir o fenótipo da doença e, consequentemente, os seus sintomas e complicações continua a ser desafiadora. No entanto, o avançar substancial do conhecimento sobre a fisiopatologia da MCH permitiu desenvolver terapêuticas com o potencial de preencher esta lacuna existente no tratamento da MCH.
Estas abordagens são altamente apelativas e poderão ser desempenhadas por diferentes fármacos e por estratégias dirigidas a mutações sarcoméricas específicas, sejam elas a modulação da contratilidade das proteínas do sarcómero ou terapêuticas genéticas. A grande maioria demonstrou, em estudos em modelos animais, a capacidade de funcionar como terapêuticas modificadoras de doença. Alguns fármacos e moléculas, como o diltiazem e MYK‐461/Mavacamtem, tiveram adicionalmente resultados positivos nos primeiros ensaios clínicos em humanos, esperando‐se no futuro novos estudos que comprovem a sua eficácia; outros fármacos, como a ranolazina, perhexilina, NAC, inibidores do SRAA ou estatinas apresentaram resultados desapontantes ou contraditórios nos ensaios feitos em humanos, aguardando alguns destes fármacos estudos adicionais que determinem cabalmente a sua eficácia (ou ausência de eficácia) no tratamento da MCH.
Uma estratégia muito promissora, dada a sua capacidade de atuar nas alterações mais primárias da fisiopatologia da MCH, é a terapêutica genética. Esta abordagem encontra‐se, no entanto, numa fase precoce do seu desenvolvimento, não existindo ainda estudos em humanos.
Estas estratégias atuam, assim, em eventos precoces e chave no desenvolvimento da MCH. Deste modo, ao contrário dos fármacos atualmente recomendados para o tratamento da MCH, que apenas procuram o alívio sintomático ou prevenção de complicações, estes novos fármacos podem atenuar ou atrasar o desenvolvimento fenotípico da patologia ou, até, prevenir o emergir da doença. Este facto torna‐se particularmente aliciante para indivíduos portadores de mutações associadas à doença, mas que ainda não expressam o seu fenótipo (indivíduos genótipo positivos‐fenótipo negativos), nos quais a prevenção do desenvolvimento de HVE ou outras alterações associadas à patologia permitirá evitar o estabelecimento da doença. Mesmo em indivíduos com doença já estabelecida, a possibilidade de estabilizar o fenótipo com as estratégias terapêuticas referidas ao longo deste artigo é de enorme interesse e importância. No entanto, não deixa de ser importante salientar alguns casos particulares de MCH, nomeadamente indivíduos portadores de mutações com penetrância tardia, nos quais a avaliação do efeito destas terapêuticas modificadoras será mais difícil de testar.
Conflito de interessesOs autores declaram não haver conflito de interesses.