O uso dos inibidores da tirosina cínase (ITC) para o tratamento da leucemia mieloide crónica alterou significativamente o prognóstico dessa doença e permitiu uma esperança de vida praticamente normal. Apesar dos seus inegáveis benefícios, o uso dos ITC está associado a um aumento do risco de efeitos colaterais sobre o sistema cardiovascular, nomeadamente no risco de eventos aterotrombóticos. Torna‐se por isso necessário conhecer e prevenir os efeitos adversos desses fármacos de modo a permitir a continuação da terapêutica antileucémica e minimizar a toxidade para os doentes. Este documento multidisciplinar, elaborado através de uma colaboração entre hematologistas e cardiologistas de vários serviços hospitalares portugueses, tem por objetivo rever a toxidade cardiovascular associada aos vários ITCs e estabelecer sugestões para o seguimento desses doentes. São ainda propostas medidas para a avaliação e redução do risco cardiovascular desses doentes, critérios de referenciação e discutidas interações medicamentosas relevantes.
The use of tyrosine kinase inhibitors (TKIs) for the treatment of chronic myeloid leukemia has significantly altered the prognosis of this disease, enabling close to normal life expectancy.
Despite their undeniable benefits, the use of TKIs is associated with an increased risk of side effects on the cardiovascular system, particularly of atherothrombotic events. It is therefore necessary to understand and prevent the adverse effects of these drugs, in order to enable antileukemic therapy to continue and to minimize patients’ toxic exposure.
This multidisciplinary consensus document, developed through a collaboration between hematologists and cardiologists, aims to review the cardiovascular toxicity associated with various TKIs and to establish recommendations for the follow‐up of these patients. Measures are also proposed for the assessment and reduction of cardiovascular risk in these patients and referral criteria, and relevant drug interactions are discussed.
O tratamento da leucemia mieloide crónica (LMC) com inibidores da tirosina‐cinase (ITC) veio modificar significativamente o prognóstico dessa doença e permitir uma sobrevivência aos cinco anos superior aos 90% com os ITC de última geração1–3.
Dado o aumento expectável da esperança de vida com essas novas terapêuticas – com uma sobrevida possivelmente sobreponível à da população em geral – levantam‐se outros problemas, relacionados com o potencial impacto no prognóstico em longo prazo dos efeitos adversos desses fármacos, nomeadamente no sistema cardiovascular. Na verdade, tem sido descrito um aumento de eventos cardiovasculares associados à LMC por si e ao tratamento com ITCs, particularmente os de segunda geração4. Esses efeitos adversos compreendem sobretudo eventos arteriais trombóticos, o que obriga à avaliação dos fatores de risco cardiovascular e à instituição de medidas de prevenção apropriadas. Contudo, o estudo das complicações cardiovasculares associadas aos ITCs tem sido dificultado pelo facto de a LMC ocorrer num grupo etário em que a prevalência de doença cardiovascular e de fatores de risco é já significativa per si. Por outro lado, na maioria dos ensaios clínicos que avaliaram a eficácia e segurança desses novos fármacos, excluíram‐se os indivíduos com doença cardiovascular prévia, pelo que não são conhecidos os efeitos dos ITC nas populações com patologia já existente. Finalmente, importa salientar que não existem até agora estudos prospetivos que tenham avaliado os efeitos dos ITCs na função ventricular e vascular, apenas são conhecidas as alterações metabólicas e os efeitos adversos major num seguimento em relativamente curto prazo5.
Os ITCs inibem o BCR‐ABL como também outras cinases, tais como PDGRF, kit e src, que são também expressas em células não hematopoiéticas, são responsáveis por efeitos adversos não hematológicos. Dos cinco ITCs atualmente disponíveis para o tratamento da LMC, o imatinib foi o primeiro e considerado standard of care durante anos. A observação de casos de resistência ou intolerância ao imatinib em alguns doentes levou ao desenvolvimento de novos ITC, com efeito mais potente na inibição do BCR‐ABL e com perfis de toxicidade distintos do imatinib. Os primeiros desses ITC de segunda geração foram o dasatinib e o nilotinib, que revelaram uma eficácia terapêutica mais elevada relativamente ao imatinib, pelo que agora equacionamos o seu uso em primeira linha6. Os restantes inibidores são usados com menor frequência. O bosutinib está indicado sobretudo em terceira linha, enquanto o ponatinib está indicado essencialmente para mutações específicas do BCR‐ABL. Os perfis de toxicidade dos três agentes mais usados, o imatinib, o dasatinib e o nilotinib, são substancialmente diferentes. Importa conhecê‐los, detetar os doentes de risco acrescido e propor atitudes preventivas e de monitoração adequadas e apropriadas. Resumem‐se seguidamente as manifestações de toxicidade cardiovascular conhecidas.
Efeitos colaterais cardiovasculares dos ITCsOs efeitos adversos cardiovasculares dos ITCs não se expressam como manifestações de classe farmacológica, são específicos de cada agente farmacológico. Uma vez que alguns ITCs só foram recentemente disponibilizados, é possível que só após um uso em longo prazo se possa ter uma avaliação mais completa de todos os efeitos colaterais.
Contudo, de um modo geral, as alterações do intervalo QT poderão potencialmente ocorrer em associação à terapêutica com ITCs, como descrito adiante para cada um dos fármacos dessa classe. Como recomendações gerais para todos os ITCs, antes do início do tratamento deverá ser avaliado o intervalo QT através do eletrocardiograma e após o seu início esse deverá ser monitorado regularmente. Como não há dados específicos, sugerimos a realização de ECG aos três meses e aos 12 meses após o início do tratamento (tabela 1). Além disso, devem ser despistadas alterações eletrolíticas, como a hipomagnesiemia e a hipocaliemia, que podem aumentar o risco de arritmias.
ImatinibRelativamente ao imatinib, a ocorrência de insuficiência cardíaca (IC) foi descrita em estudos iniciais, não controlados. Num estudo in vitro, o imatinib afetou o potencial de membrana mitocondrial e a ultraestrutura celular, induzindo apoptose7. Estudos posteriores, que envolveram populações de maior dimensão, e análises de bases de dados multicêntricas não demonstraram aumento da incidência de insuficiência cardíaca, apenas foram registadas a incidência esperada para o grupo etário e comorbilidades5. Numa revisão de 1276 doentes, a grande maioria daqueles que desenvolveram IC já tinha fatores de risco para IC8. Outro efeito associado ao imatininb é a retenção hidro‐salina, que é clinicamente ligeira, sendo os eventos graves como o derrame pleural de ocorrência rara. Entre as recomendações para os doentes tratados com imatinib encontram‐se a monitoração cardíaca em doentes com cardiopatia prévia, que deverá ser efetuada através de seguimento em consulta de cardiologia.
DasatinibNo que respeita ao dasatinib, esse pode‐se associar ao desenvolvimento de derrame pleural ou pericárdico, que ocorrem em cerca de 20% dos doentes9,10. Para os doentes em risco de desenvolver derrame pleural, nomeadamente com história de doença pulmonar ou insuficiência cardíaca congestiva, torna‐se necessário ponderar outro ITC. A hipertensão pulmonar (HTP) é também uma complicação que pode ocorrer com o dasatinib, pode ocorrer em 0,35% dos casos10,11, pelo que nos doentes com HTP pré‐existente podem ser considerados para ITCs opcionais. Raramente, em < 1% dos casos, pode também ocorrer prolongamento do intervalo QT nos doentes tratados com dasatinib.
NilotinibSobre os efeitos colaterais do nilotinib foi também descrito o prolongamento do intervalo QT em alguns estudos12. Contudo, em nenhum dos estudos publicados se verificou o aumento do intervalo QT corrigido para > 500ms, revelou‐se que a segurança do nilotinib é a esse respeito elevada13. Tal como supracitado, recomenda‐se também a monitoração basal e no seguimento do ECG, assim como a atenção à administração de antiarrítmicos ou outros fármacos que prolonguem o intervalo QT e a correção da hipomagnesemia e da hipocaliemia.
Uma das toxicidades cardiovasculares mais debatidas dos ITCs de segunda geração são os eventos trombóticos arteriais. Uma análise do registo oncológico sueco revelou que a LMC por si aumenta a frequência de eventos cardiovasculares14. Adicionalmente, os ITC de segunda geração, nilotinib e dasatinib, estão associados a uma maior incidência desses eventos quando comparados com imatinib4. Essa observação está confirmada na análise comparativa dos eventos CV observados nos ensaios clínicos, nos quais esses ITC foram comparados com imatinib. Neste estudo verificou‐se uma incidência de eventos trombóticos arteriais de 5% com dasatinib comparados com 2% com imatinib e de 15,9% e 10% com as doses de 400mg e 300mg de nilotinib, respetivamente, comparados com 2,5% com imatinib. Esses eventos são ainda mais frequentes com ponatinib5, atingem uma incidência de 17,5%. Nesse contexto é particularmente importante referir que, apesar de mais frequente com ITC de segunda geração, a mortalidade associada a eventos trombóticos nos braços de ITC de segunda geração nos ensaios acima referidos não é superior àquela observada no braço dos doentes tratados com imatinib. Por outro lado, a mortalidade causada pela progressão de LMC é superior nos doentes tratados com imatinib do que naqueles tratados com dasatinib ou nilotinib, o que reforça a importância da eficácia antileucémica nesses doentes. Estudos retrospetivos multicêntricos de grande dimensão encontraram como fatores de risco major para o desenvolvimento de doença vasculo‐arterial periférica a idade mais avançada, o tempo de duração do tratamento e alterações metabólicas como a hipercolesterolemia ou a diabetes15. Numa análise que incluiu dados dos ensaios IRIS, TOPS, e ENESTnd, 92% dos doentes que vieram a manifestar doença vasculo‐arterial periférica tinham fatores de risco cardiovasculares, como diabetes, dislipidemia, hipertensão, idade avançada e tabagismo16. No ensaio ENESTnd, em cerca de 85% dos casos de síndrome coronária aguda havia pelo menos um fator de risco de aterosclerose prévio à terapêutica. Outro estudo revelou uma associação significativa de acidentes isquémicos com os níveis de colesterol e com outros fatores de risco cardiovascular17.
Enquanto os efeitos metabólicos conhecidos do nilotinib, potenciados na presença de hiperglicemia e hipercolesterolemia, podem aumentar a frequência de eventos cardiovasculares, devemos considerar que a população de doentes com LMC, com uma média de 67 anos, pertence a um grupo etário no qual a probabilidade de acidentes isquémicos é já importante, não só pela própria idade, mas pela agregação de fatores de risco. Por esses motivos tem sido discutido se os casos de acidentes isquémicos fazem parte da história natural dos doentes ou são secundários à terapêutica com nilotinib13. O nilotinib poderá, por outro lado, atuar aditivamente a fatores de risco cardiovasculares estabelecidos ou outras comorbilidades, por efeitos vasculares diretos (interação com o domínio do recetor 1 de discoidina [DDR1]) ou pelos efeitos metabólicos no nível da glicemia e colesterolemia, todos contribuem para a doença aterosclerótica oclusiva. É também levantada a questão da possível subestimativa da doença vascular que poderá já existir em fase pré‐clínica antes do início da terapêutica.
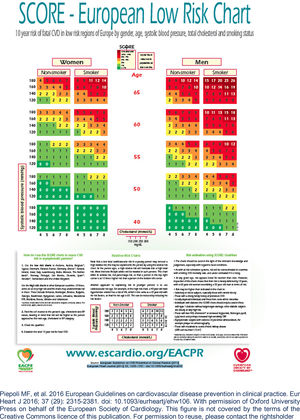
Recentemente, Brescia et al.18 avaliaram retrospetivamente uma série de doentes com LMC tratados com nilotinib. Aplicando o algoritmo de risco de doença cardíaca aterosclerótica da Sociedade Europeia de Cardiologia19, na sua versão para os países europeus de baixo risco de que faz parte Portugal, classificaram‐se em graus de risco de eventos os doentes na fase pré‐tratamento (e de seguimento) com nilotinib – baixo (< 1%), moderado (1‐5%), elevado (5‐10%) e muito elevado (> 10%) – tendo em conta as variáveis propostas (idade, sexo, colesterol, pressão arterial sistólica, tabagismo, diabetes, insuficiência renal, obesidade, doença cardiovascular prévia). Os autores encontraram uma incidência de 8,5% de acidentes isquémicos aos 48 meses de seguimento. As várias categorias de risco associaram‐se a graus crescentes de incidência de eventos isquémicos, que foi nula para o grupo de baixo risco. Este trabalho sugere a necessidade de deteção precoce e ao longo do tratamento dos fatores de risco de aterosclerose de forma a evitar os eventos isquémicos. Especificamente, em cada consulta o doente deve ser questionado relativamente a sintomas de angina e de claudicação intermitente.
No que diz respeito ao efeito do nilotinib, e também do dasatinib e do imatinib, na função ventricular, a maioria dos estudos excluiu os doentes com disfunção ventricular prévia e outros não efetuaram um estudo sistemático dirigido à função, nomeadamente recorreram à ecocardiografia sistemática. Não há assim de momento informação disponível que sugira que os ITCs afetem de forma significativa a função sistólica ventricular, avaliada pela fração de ejeção. Um estudo encontrou alterações da função diastólica, o que pode sugerir alterações mais subtis no nível da função ventricular20. Na atualidade, não existe evidência suficiente que demonstra que a função ventricular seja afetada significativamente, o que estudos futuros deverão explorar, nomeadamente se incluírem índices mais sensíveis de função ventricular.
BosutinibRelativamente ao bosutinib, a maioria dos estudos publicados não demonstrou aumento da incidência dos eventos cardiovasculares21,22. Contudo, o bosutinib inibe vias de sinalização que também são inibidas pelo ponatinib, como as cínases da família SRC, pelo que até o completo esclarecimento dos mecanismos etiopatogénicos da toxicidade CV dos ITCs os hipotéticos eventos cardiovasculares associados com o bosutinib devem ser monitorados23. Relativamente ao efeito sobre o intervalo QTc, a maioria dos estudos não encontrou aumento da sua duração; num estudo de 288 doentes com LMC, observou‐se um prolongamento pouco significativo em dois doentes (um > 500ms, outro aumento > 60ms), o que sugere um perfil seguro para o fármaco, mas confirma a necessidade de avaliação e monitoração eletrocardiográfica.23
PonatinibEmbora existam ainda poucos estudos publicados, o ponatinib parece estar associado a risco significativo de eventos cardiovasculares, sobretudo arteriais (doença arterial oclusiva em 20%), mas também venosos24. Por outro lado, a HTA é um efeito lateral frequentemente associado ao ponatinib, pelo que deve ser assegurado o seu controlo25.
Sugestão para a avaliação e monitoração do risco CV em doentes com LMC sob tratamento com ITCs
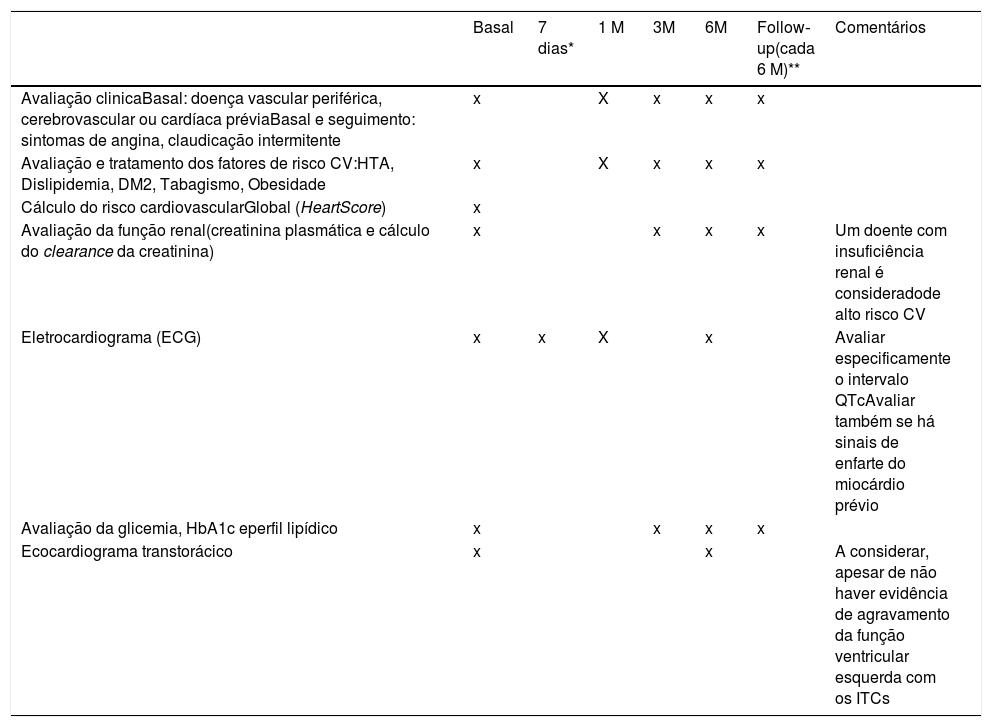
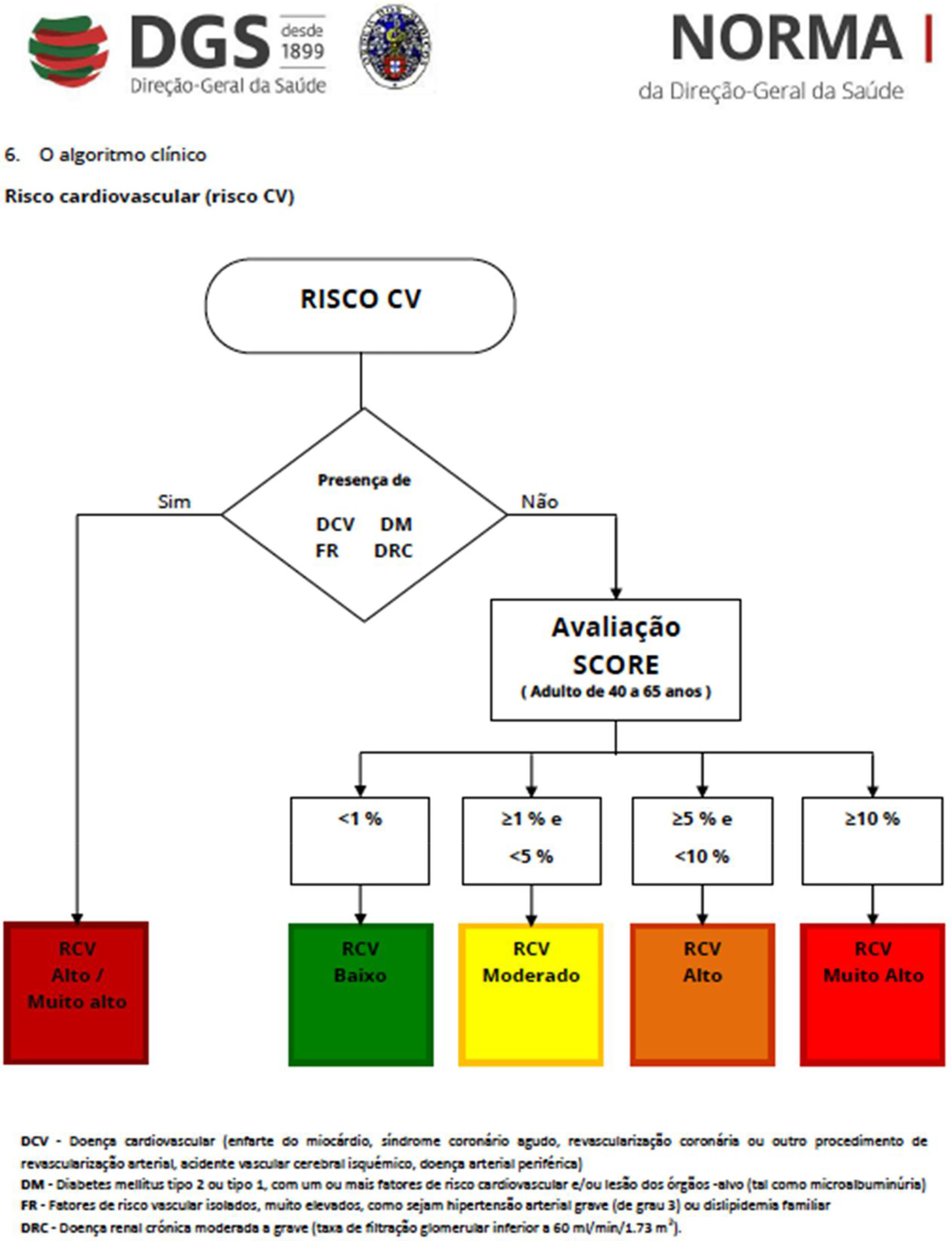
Tendo em conta a informação atualmente disponível, propomos o algoritmo em anexo como sugestão para a avaliação (Anexos 1 e 2) e seguimento dos doentes tratados com ITCs (tabelas 1, 2, 3 e 4).
Recomendações para a avaliação inicial e seguimento dos doentes sob terapêutica com ITCs
| Basal | 7 dias* | 1 M | 3M | 6M | Follow‐up(cada 6 M)** | Comentários | |
|---|---|---|---|---|---|---|---|
| Avaliação clinicaBasal: doença vascular periférica, cerebrovascular ou cardíaca préviaBasal e seguimento: sintomas de angina, claudicação intermitente | x | X | x | x | x | ||
| Avaliação e tratamento dos fatores de risco CV:HTA, Dislipidemia, DM2, Tabagismo, Obesidade | x | X | x | x | x | ||
| Cálculo do risco cardiovascularGlobal (HeartScore) | x | ||||||
| Avaliação da função renal(creatinina plasmática e cálculo do clearance da creatinina) | x | x | x | x | Um doente com insuficiência renal é consideradode alto risco CV | ||
| Eletrocardiograma (ECG) | x | x | X | x | Avaliar especificamente o intervalo QTcAvaliar também se há sinais de enfarte do miocárdio prévio | ||
| Avaliação da glicemia, HbA1c eperfil lipídico | x | x | x | x | |||
| Ecocardiograma transtorácico | x | x | A considerar, apesar de não haver evidência de agravamento da função ventricular esquerda com os ITCs |
Explicar por baixo da tabela as diferenças entre as cruzes “X” e “x”
* Aconselhável, seguindo as recomendações da FDA.
** Até estabilização hematológica.
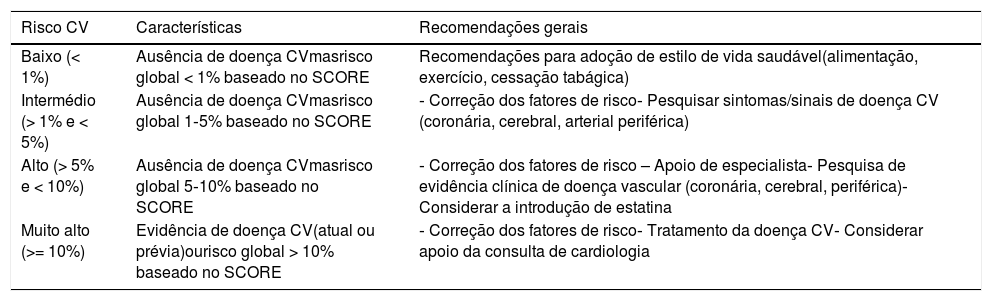
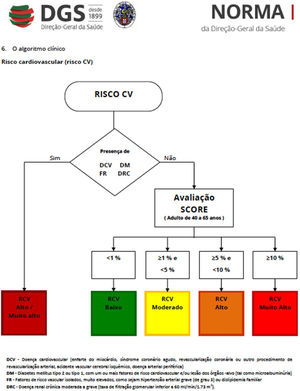
Classificação do risco cardiovascular global e respetivas recomendações para cada categoria de risco*
| Risco CV | Características | Recomendações gerais |
|---|---|---|
| Baixo (< 1%) | Ausência de doença CVmasrisco global < 1% baseado no SCORE | Recomendações para adoção de estilo de vida saudável(alimentação, exercício, cessação tabágica) |
| Intermédio (> 1% e < 5%) | Ausência de doença CVmasrisco global 1‐5% baseado no SCORE | ‐ Correção dos fatores de risco‐ Pesquisar sintomas/sinais de doença CV (coronária, cerebral, arterial periférica) |
| Alto (> 5% e < 10%) | Ausência de doença CVmasrisco global 5‐10% baseado no SCORE | ‐ Correção dos fatores de risco – Apoio de especialista‐ Pesquisa de evidência clínica de doença vascular (coronária, cerebral, periférica)‐ Considerar a introdução de estatina |
| Muito alto (>= 10%) | Evidência de doença CV(atual ou prévia)ourisco global > 10% baseado no SCORE | ‐ Correção dos fatores de risco‐ Tratamento da doença CV‐ Considerar apoio da consulta de cardiologia |
*De acordo com o modelo SCORE da Sociedade Europeia de Cardiologia e as Normas da Direção Geral de Saúde (ver Anexos 1 e 2)
O cálculo do risco cardiovascular global é estimado com base no risco de eventos cardiovasculares no seguimento a 10 anos
Fármacos que podem ser usados em associação com ITCs para o controlo dos fatores de risco cardiovascular
| Fator de risco | Grupo farmacológico | Fármacos | Comentários |
|---|---|---|---|
| Dislipidemia | Estatinas | PravastatinaPitavastatinaAtorvastatinaRosuvastatina | Pravastatina e pitavastatina não interferem com o citocromo P450Vigiar os valores de CKSinvastatina e lovastatina deverão ser evitadas |
| HTA | Inibidores da enzima de conversão da angiotensina (IECAs) | EnalaprilLisinoprilRamiprilPerindoprilOutros | Vigiar os níveis de potássio e função renal |
| Antagonistas dos recetores da angiotensina (ARAs) | CandesartanIrbesartanOutros | Vigiar os níveis de potássio e função renal | |
| Bloqueadores‐beta | BisoprololCarvedilolNebivolol | Vigiar a frequência cardíaca (FC) | |
| Antagonistas dos canais de cálcio | NifedipinaAmlodipinaDiltiazemVerapamil | Vigiar a frequência cardíaca nos doentes medicados com diltiazem ou verapamil | |
| Diuréticos | TiazidasIndapamida | Controlar ionograma | |
| Diabetes | Antidiabéticos orais | Metformina (recomendada como tratamento inicial) |
Lista de fármacos que aumentam o intervalo QT
| Anti‐infecciosos | Doenças neuropsiquiátricas |
|---|---|
| Azitromicina (Zitromax®)Ciprofloxacina (Ciplox®, Ciproxina®)Claritromicina (Klacid®)Eritromicina (Eritrocina®)Levofloxacina (Tavanic®)Moxifloxacina (Avelox®)Metronidazol (Flagyl®)Ofloxacine (Oflocet®)Trimetoprim‐Sulfametoxazol (Bactrim®)Fluconazole (Diflucan®)Itraconazole (Sporanox®)Cetoconazole (Nizoral®)VoriconazoleAntimaláricos | Citalopram (Zitolex®)Cloropromazina (Largactil®)Clomipramina (Anafranil®)Clozapina (Leponex®)Fluoxetina (Prozac®, Diagassim®)Haloperidol (Haldol®)Imipramine (Tofranil®)Levomepromazina (Nozinan®)LitioOpioides: MetadonaMetilfenidato (Concerta® Ritalina®)Nortriptilina (Norterol®)Olanzapina (Zyprexa®)Paroxetina (Seroxat®, Paxetil®)Quetipina (Seroquel®)Risperidona (Risperdal®)Sertralina (Zoloft®)Tizanidina (Sirdalud®)Venlafaxina (Efexor®)Nota: os antidepressivos tricíclicos têm maior risco de prolongamento do intervalo QT que os inibidores da recaptação da serotonina |
| Doenças cardiovasculares | Diversos |
| Amiodarona (Cordarone®)Flecainida (Apocard®)Propafenona (Rythmonorm®)Sotalol (Darob®)Adrenalina (Epipen®)Ranolazina (Ranexa®)Outros antiarrítmicos que aumentam o QT (não vendidos em farmácia de ambulatório): quinidina, procainamida, disopiramida, dofetilide, ibutilide | Alfuzosina (Benestan®)TacrolimusOndansetron, granisetron, dolasetronDomperidona (Motilium®, Cinet®)Antirretrovíricos (alguns): lopinavir, nelfinavir, saquinavir |
Os fármacos dessa tabela podem aumentar o intervalo QTc26,27. As decisões quanto ao uso de fármacos que prolonguem o intervalo QT devem ser tomadas com base numa análise de risco‐benefício. Se possível devem ser usados fármacos opcionais. Em caso de necessidade de uso desses fármacos deve ser feita monitoração regular do intervalo QTc por eletrocardiograma. Baseado em Nielsen et al. e em Li et al.
Nota: Dentro de cada categoria, os fármacos são mostrados por ordem alfabética; foram incluídos os nomes comerciais dos fármacos vendidos em ambulatório em Portugal.
Independentemente das comorbilidades do doente, não existem contraindicações absolutas para qualquer um dos ITCs.
O objetivo será estabelecer um equilíbrio, tentar obter a máxima eficácia com menor perfil de toxicidade. Todavia, como a eficácia antileucémica é a principal preocupação na doença avançada, o perfil de toxicidade poderá passar para segundo plano.
Nos doentes de muito alto risco CV com LMC em fase crónica recém‐diagnosticada, o imatinib e dasatinib são atualmente as opções terapêuticas preferenciais. Nesse grupo de doentes, o nilotinib não está recomendado e estará indicado só após avaliação criteriosa dos factores de risco CV, gravidade e benefício terapêutico expectável com esse ITC. Nos doentes com risco CV ligeiro e moderado, qualquer um dos ITCs pode ser prescrito.
Em doentes com doença arterial periférica previamente diagnosticada o ponatinib não deve ser usado. Perante doença arterial periférica grave prévia, o nilotinib não está recomendado, apesar de poder ser instituído nos casos de doença arterial periférica ligeira a moderada, após avaliação dos riscos e benefícios5.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.