A avaliação seriada da fração de ejeção ventricular esquerda (FEVE) é o padrão de referência na vigilância da cardiotoxicidade induzida por quimioterapia (CIT). A avaliação da deformação longitudinal com técnicas de speckle tracking permite uma avaliação mais detalhada da contractilidade miocárdica. O objetivo deste estudo foi avaliar a relação entre a deformação longitudinal global (GLS) e regional e a incidência de CIT.
MétodosForam incluídos 158 pacientes num estudo prospetivo observacional de doentes com neoplasia da mama submetidos a quimioterapia com antraciclinas, com ou sem terapêutica adjuvante com trastuzumab. Foi efetuada uma monitorização ecocardiográfica seriada de parâmetros de função sistólica e diastólica, incluindo a avaliação da deformação miocárdica longitudinal bidimensional. A incidência de CIT foi definida como uma diminuição da FEVE para valor<53%, de acordo com o documento de consenso da Sociedade Europeia de Imagiologia Cardiovascular (EACVI). Os doentes foram classificados como tendo deterioração da contractilidade miocárdica para um valor de GLS menos negativo que ‐18%, de acordo com os critérios da EACVI.
ResultadosDurante um período de seguimento médio de 5,4 meses (1‐48 meses), a incidência de CIT foi de 18,9%. Na população global observou‐se uma deterioração significativa do GLS durante o tratamento com quimioterapia (‐20,1±3,5% versus 18,7±3,4%, p=0,001), com compromisso do GLS detetado durante em algum período do seguimento em 61,4% dos doentes. Esta deterioração foi mais marcada no subgrupo de doentes com CIT (GLS: ‐17,2±2,5%, p=0,02). Na análise regional da deformação longitudinal, verificou‐se compromisso da contractilidade envolvendo preferencialmente os segmentos septais (seis em seis) e parede anterior (dois em três). Por regressão logística multivariada, o compromisso do GLS esteve independentemente associado ao desenvolvimento de CIT (odds ratio 4,88, IC 1,32‐18,0, p=0,017).
ConclusõesO compromisso da deformação longitudinal é frequente em doentes submetidos a quimioterapia e mostrou um padrão de distribuição predominante a nível septal e anterior. A degradação da GLS foi um preditor independente de CIT.
Serial echocardiographic assessment of left ventricular ejection fraction (LVEF) is the gold standard in screening for chemotherapy‐induced cardiotoxicity (CIC). Measurement of myocardial deformation using speckle tracking enables more detailed assessment of myocardial contractility. The aim of this study was to determine the relationship between global and regional longitudinal strain and CIC.
MethodsThis was a prospective study of 158 breast cancer patients undergoing chemotherapy with anthracyclines with or without adjuvant trastuzumab who underwent serial monitoring by transthoracic echocardiography with assessment of myocardial deformation. CIC was defined as a decrease in LVEF to <53%. Global longitudinal strain (GLS) was estimated using EchoPAC BT12 software on a GE Vivid E9 cardiac ultrasound system. Patients were classified according to the 2015 ASE/EACVI criteria as having impaired myocardial deformation when GLS was reduced (less negative), with a cutoff of ‐18%.
ResultsDuring a mean follow‐up of 5.4 months (1‐48 months), the incidence of CIC was 18.9%. A decrease in GLS was observed during follow‐up for the entire cohort (baseline GLS ‐20.1±3.5% vs. ‐18.7±3.4% at last follow‐up assessment, p=0.001). A total of 97 patients (61.4%) were observed to have impaired myocardial deformation (GLS ≥18%) at some point during follow‐up. This decrease was more significant in patients who eventually developed CIC (GLS ‐17.2±2.5%, p=0.02). On analysis of regional strain, impaired contractility was observed in the septal (6 out of 6) and anterior (2 out of 3) segments. Multivariate logistic regression showed that patients who developed impaired longitudinal strain had a 4.9‐fold increased risk of developing CIC (odds ratio 4.88, confidence interval 1.32‐18.0, p=0.017).
ConclusionsWorsening of myocardial deformation as assessed by speckle tracking is common in breast cancer patients undergoing chemotherapy, with predominantly septal and anterior wall involvement. Impaired myocardial deformation was independently associated with increased incidence of CIC.
As antraciclinas e, mais recentemente, o trastuzumab, um anticorpo monoclonal dirigido ao recetor HER2, são rotineiramente utilizados no tratamento da neoplasia da mama1,2. No entanto, rapidamente se reconheceu que a utilização destes fármacos pode levar à degradação da função sistólica do ventrículo esquerdo, avaliada através da fração de ejeção do ventrículo esquerdo (FEVE) e à instalação clínica de insuficiência cardíaca3–5. De facto, a cardiotoxicidade induzida por fármacos de quimioterapia (CIT) é um dos principais determinantes de prognóstico em sobreviventes a neoplasia da mama6,7, embora apenas um pequeno subgrupo de doentes expostos a estas terapias vem a desenvolver CIT, com uma incidência descrita entre 3‐12% para terapia isolada com antraciclinas e até 28% em combinação com trastuzumab.
Neste contexto, são necessárias estratégias eficazes para a monitorização e deteção atempada da CIT, com especial foco na melhor compreensão dos mecanismos de degradação da contractilidade miocárdica.
A tecnologia de peckle tracking, hoje disponível comercialmente numa variedade de dispositivos de ecocardiografia, permite uma avaliação da deformação do miocárdio nos seus diferentes componentes – longitudinal, radial e circunferencial. De facto, a deterioração da deformação longitudinal global (GLS) em pacientes com fração de ejeção preservada está associada à incidência de eventos adversos cardiovasculares numa variedade de contextos clínicos8,9.
O objetivo dos autores foi caracterizar a evolução da contractilidade miocárdica, conforme avaliado pela deformação longitudinal regional e GLS, em doentes submetidos a quimioterapia no tratamento de neoplasia da mama. Adicionalmente, procurou‐se estabelecer se a observação de alterações da contractilidade miocárdica, precedendo a descida da FEVE, permite prever o desenvolvimento de CIT.
MétodosDesenho do estudoFoi efetuado um estudo prospetivo observacional de pacientes com neoplasia da mama submetidos a quimioterapia com antraciclinas, com dose programada ≥240mg/m2 de doxorubicina ou equivalente, com ou sem imunoterapia adjuvante, entre junho de 2011 e outubro de 2015. A referenciação dos doentes foi efetuada a partir do serviço de oncologia do centro hospitalar. Foram incluídos todos os doentes referenciados para avaliação ecocardiográfica prévia ao início da quimioterapia, e seguidos durante o decurso do tratamento de quimioterapia com antraciclinas. Foram excluídos os doentes que referissem antecedente pessoal de patologia cardíaca, ou com achados com significado patológico no ecocardiograma inicial, definida como FEVE<53%, diâmetro telediastólico do VE>60mm, espessura das paredes do VE>12mm, insuficiência valvular moderada ou grave ou presença de cardiopatia congénita. Foram recolhidos dados demográficos, da terapêutica antineoplásica em curso, bem como referentes às variáveis ecocardiográficas.
Aquisição ecocardiográfica e pós‐processamentoA avaliação ecocardiográfica inicial e de seguimento foram realizadas de acordo com a indicação clínica estabelecida pelo oncologista. Os ecocardiogramas foram efetuados num aparelho Vivid 9 ou Vivid 7 da marca GE. Os doentes efetuaram aquisições ecocardiográficas nos planos parasternal longo‐eixo e curto‐eixo, bem como apical quatro câmaras, duas câmaras e três câmaras. Um subgrupo de doentes (99 pacientes, 63,1%) foi também submetido a análise com Doppler tecidular. A FEVE foi avaliada com utilização do método de Simpson biplanar.
A análise de deformação longitudinal foi efetuada off‐line após aquisição das incidências apical três câmaras, duas câmaras e quatro câmaras, utilizando um algoritmo semiautomático disponível no software EchoPAC BT 12. Os resultados para a deformação longitudinal foram analisados como avaliação regional, utilizando um modelo de 18 segmentos, e a média destes 18 segmentos foi usada para calcular a GLS. A variabilidade interobservador e intraobservador da avaliação da deformação longitudinal em pacientes submetidos a quimioterapia com antraciclinas já foi previamente reportada10.
DefiniçõesA CIT foi definida como uma redução da FEVE abaixo de 53%, de acordo com os critérios do documento de consenso de 2014 para avaliação multimodal em doentes adultos submetidos a quimioterapia da Sociedade Americana de Ecocardiografia (ASE) e a Associação Europeia de Imagiologia Cardiovascular (EACVI)11. Relativamente à GLS, esta foi definida como estando alterada (menos negativa), utilizando o limiar recomendado pela ASE/EACVI para o EchoPAC BT 12 de ‐18%12.
Análise estatísticaA análise da variação da FEVE e GLS e segmentar foi efetuada comparando o ecocardiograma basal e os ecocardiogramas efetuados durante o seguimento. No caso de existir mais do que um ecocardiograma no período de seguimento, foi utilizado o valor correspondente à maior variação das variáveis estudadas.
Para estudar as variáveis preditoras de CIT, utilizou‐se uma análise de regressão logística para a variável dependente de incidência de CIT durante o seguimento, sendo incluídas no modelo variáveis referentes aos dados demográficos, ecocardiograma basal, terapêutica antineoplásica e a presença ou ausência de compromisso do GLS durante o seguimento precedendo o desenvolvimento de CIT. As variáveis com valor de p<0,05 em análise univariada foram incluídas num modelo multivariado.
A comparação entre variáveis contínuas com distribuição normal foi efetuada com recurso ao teste de t de Student. A comparação entre variáveis categóricas foi efetuada utilizando o teste de qui‐quadrado. Considerou‐se um valor p<0,05 como sendo estatisticamente significativo.
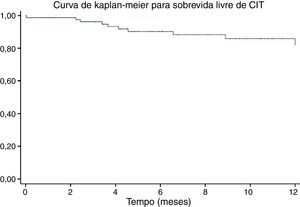
ResultadosCaracterização da população e seguimento ecocardiográficoUm total de 165 mulheres foram avaliadas, sendo excluídas sete doentes com disfunção VE no ecocardiograma basal, sendo incluídos 158 doentes na análise final. Observou‐se uma duração de seguimento média de 5,4 meses (1‐48 meses), com tempo de avaliação total de 71,1 pessoa‐anos. Todos os pacientes realizaram no mínimo dois estudos ecocardiográficos, tendo em média efetuado 3,6 ecocardiogramas, com um intervalo médio entre exames de 107 dias.
A idade média foi de 54,6 anos±12,9 anos, com 33% dos doentes submetidos a imunoterapia e 16,5% dos doentes submetidos a radioterapia. As variáveis ecocardiográficas basais estão descritas na Tabela 1. Não se observaram óbitos de causa cardiovascular.
Características basais
| Idade (anos) | 54,6±12,9 | |
| Sexo feminino | 158 (100%) | |
| Quimioterapia com antraciclinas | 158 (100%) | |
| Imunoterapia | 52 (33%) | |
| Radioterapia | 26 (16,5%) | |
| Duração de seguimento (meses) | 5,4 (1‐48 meses) | |
| Óbito de causa oncológica | 4 (2,5%) | |
| Variáveis ecocardiográficas | Média | Desvio padrão |
|---|---|---|
| Diâmetro telediastólico VE (mm) | 48,5 | 6,3 |
| Diâmetro telessistólico VE (mm) | 29,0 | 5,6 |
| Fração de encurtamento (%) | 40,1% | 9,2% |
| FEVE (%) | 62,0% | 8,4% |
| Volume telediastólico VE (mL) | 75,6 | 23 |
| Volume telessistólico VE (mL) | 28,6 | 14,6 |
| Velocidade onda E transmitral (cm/s) | 75,7 | 20,6 |
| Velocidade onda A transmitral (cm/s) | 79,3 | 19,2 |
| Rácio E/A | 0,99 | 0,33 |
| S’ septal (cm/s) | 7,47 | 1,77 |
| S’ lateral (cm/s) | 8,89 | 2,45 |
| S’ tricúspide (cm/s) | 12,5 | 2,5 |
| Rácio E/e’ | 9,2 | 2,9 |
A definição de CIT foi previamente referenciada nos métodos. A incidência de CIT na população estudada durante o período de seguimento foi de 18,9% (Figura 1); observou‐se uma maior incidência de CIT no subgrupo de doentes submetidos em simultâneo a terapêutica com trastuzumab (38,1 versus 11,7%, p=0,001).
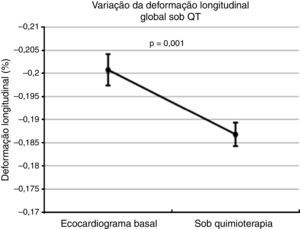
Deformação longitudinal globalDurante o seguimento verificou‐se um agravamento significativo da GLS, passando de um valor basal de ‐20,1±3,5% para ‐18,7±3,4% (Figura 2, p=0,001, t de Student). Esta deterioração foi mais marcada no subgrupo de doentes que desenvolveram CIT (GLS ‐17,2±2,5%, p=0,02). Considerando toda a população, observou‐se compromisso contractilidade miocárdica numa proporção significativa dos doentes, com agravamento da GLS ultrapassando o limiar de ‐18% em 61,4% dos doentes (97 doentes).
Evolução da deformação longitudinal global no ecocardiograma basal e sob quimioterapia para a população global de doentes. Observa‐se uma deterioração da deformação longitudinal global sob quimioterapia. O valor central representa o valor de GLS médio; as barras de erro representam o intervalo de confiança de 95% para o erro padrão. QT: quimioterapia.
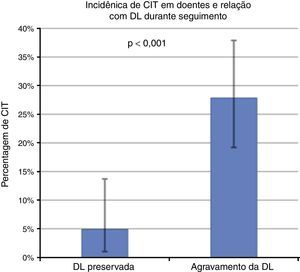
Dos 97 doentes em que se verificou agravamento da deformação longitudinal, 27 acabaram por desenvolver CIT, enquanto que apenas 3 em 61 doentes com deformação longitudinal preservada desenvolveram CIT (27,8 versus 4,9%, p<0.001, qui‐quadrado; Tabela 2, Figura 3); nos doentes que desenvolveram agravamento do GLS e posteriormente CIT, a CIT foi precedida pelo agravamento do GLS numa média de 101 dias. Por regressão logística, o agravamento da GLS esteve associado a uma incidência aumentada de CIT (odds ratio [OR] 7,45, intervalo de confiança 2,15‐25,8, p=0,002). Numa análise multivariada, as duas variáveis independentemente associadas à incidência de CIT foram a imunoterapia (OR 3,14, IC 1,21‐8,2, p=0,018) e a diminuição da GLS para o cut‐off de ‐18% (OR 4,88, IC 1,32‐18,0, p=0,017) – Tabela 3. Uma análise de subgrupo excluindo doentes submetidos a imunoterapia também mostrou resultados semelhantes para o risco de desenvolver CIT, caso se verificasse deterioração da GLS (OR 6,24, IC 1,32‐29,3, p=0,020).
Caracterização de desenvolvimento de CIT e compromisso da deformação longitudinal durante seguimento
| Sem CIT | CIT | Total | |
|---|---|---|---|
| Deformação longitudinal preservada | 58 (36,7%) | 3 (1,9%) | 61 (38,6%) |
| Agravamento da deformação longitudinal | 70 (44,3%) | 27 (17,1%) | 97 (61,4%) |
| Total | 128 (81,0%) | 30 (18,9%) | 158 (100%) |
Incidência de CIT após estratificação por doentes, em que se verificou ou não deterioração da deformação longitudinal global. Nos doentes com agravamento da DL durante seguimento existe uma incidência significativamente maior de CIT. As barras de erro representam o intervalo de confiança de 95% calculado através do método binomial. CIT: cardiotoxicidade induzida por quimioterapia; DL: deformação longitudinal.
Análise univariada e multivariada de preditores de CIT
| Análise univariada | p= | Análise multivariada | p= | |
|---|---|---|---|---|
| Idade | Odds ratio (OR) 1,01 | 0,832 | ||
| CI 0,95‐1,05 | ||||
| Trastuzumab | OR 4,33 | 0,001 | OR 3,14 | 0,018 |
| CI 1,87‐10,1 | IC 1,21‐8,2 | |||
| Radioterapia | OR 2,47 | 0,079 | ||
| CI 0,90‐6,82 | ||||
| Volume telediastólico | OR 0,99 | 0,665 | ||
| CI 0,97‐1,02 | ||||
| Fração de ejeção VE basal | OR 0,01 | 0,186 | ||
| CI 0,00‐8,96 | ||||
| Desenvolvimento de compromisso de GLS (>‐18%) | OR 7,45 | 0,002 | OR 4,88 | 0,017 |
| CI 2,15‐25,83 | IC 1,32‐18,0 |
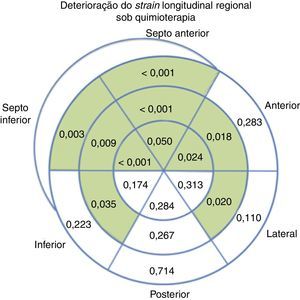
Foi possível determinar a deformação longitudinal regional em 93,1% dos segmentos analisados, com menor sucesso no segmento laterobasal (86,1%) e posterobasal (81,4%). Quando comparado ao ecocardiograma basal, nos ecocardiogramas efetuados sob terapêutica observou‐se uma deterioração da deformação longitudinal regional em dez de 18 segmentos do VE (Figura 4).
DiscussãoNeste estudo prospetivo de avaliação ecocardiográfica com deformação longitudinal em doentes com neoplasia da mama submetidos a quimioterapia (QT), o principal achado foi uma associação independente entre a deterioração da GLS com FEVE preservada e a incidência de CIT. De facto, nos doentes com deterioração do GLS (valor menos negativo que ‐18%), a incidência de CIT foi muito elevada (28,7%). Embora um valor de GLS preservado não tenha excluído o desenvolvimento de CIT na nossa população, trata‐se de um achado que indica um prognóstico mais favorável do ponto de vista da função cardiovascular, apresentando estes doentes uma probabilidade 4,9 vezes menor de desenvolver CIT.
Tanto quanto é conhecimento dos autores, este é o estudo com maior número de doentes alguma vez realizado na avaliação da deformação longitudinal na cardiotoxicidade induzida por fármacos antineoplásicos13. A nossa população de doentes é semelhante às avaliadas em estudos prévios de cardiotoxicidade em doentes com neoplasia da mama14,15, sugerindo que os nossos dados podem ser utilizados para identificar um subgrupo de alto risco para desenvolvimento de CIT.
Durante o decurso da quimioterapia com antraciclinas observámos uma deterioração da GLS, com a maioria dos doentes apresentando pelo menos uma avaliação ecocardiográfica com GLS abaixo do limiar da normalidade. Esta observação sugere a presença de lesão subclínica da contractilidade miocárdica, mesmo em doentes que não desenvolvem CIT, observação suportada por estudos prévios com Doppler tecidular16,17.
A utilização da análise segmentar da deformação longitudinal parece viável nesta população, com análise bem‐sucedida em 93,1% dos segmentos avaliados, correspondendo em média a 17 de 18 segmentos por doente. Observou‐se uma deterioração progressiva da deformação regional sob quimioterapia, sendo que esta deterioração envolveu principalmente os segmentos do septo interventricular (seis em seis) e da parede anterior, poupando a parede posterior e a maioria dos segmentos das outras paredes. Este envolvimento preferencial do septo já foi previamente descrito na avaliação ecocardiográfica com avaliação visual da cinética segmentar18, bem como por RMN cardíaca19. Este achado é também concordante com um estudo previamente publicado que refere compromisso da deformação longitudinal na parede septal, anteroseptal, anterolateral e apical em 27 doentes submetidos a quimioterapia com antraciclinas15. Embora este achado deva ser validado em estudos futuros, o reconhecimento deste padrão de envolvimento septal e anterior poderá ser útil na monitorização da cardiotoxicidade associada à QT.
O interesse na deformação longitudinal e em técnicas precoces de deteção de lesão subclínica, neste contexto, é sublinhado pelo facto de até 58% dos doentes com CIT não recuperarem uma função sistólica normal5. Embora já existam estudos multicêntricos20,21 e uma meta‐análise recente13, suportando a utilização de técnicas de speckle tracking na monitorização da cardiotoxicidade por antraciclinas e trastuzumab, estas ainda não são utilizadas de forma regular na prática clínica. Os resultados deste estudo estão em linha com os resultados previamente descritos, reforçando o valor da deformação longitudinal tanto na avaliação da cardiotoxicidade subclínica como na sinalização de doentes de alto risco para desenvolvimento de CIT.
Existem algumas limitações a este estudo. O facto de os ecocardiogramas terem sido efetuados por indicação clínica, ao invés de intervalos previamente estabelecidos, pode ter levado à ausência de dados ecocardiográficos que de outra forma teriam sido colhidos de forma sistemática em intervalos pré‐definidos. A duração média de seguimento rondou os seis meses, sendo essa a duração habitual da vigilância ecocardiográfica clínica durante tratamento com fármacos cardiotóxicos; no entanto, observou‐se alguma heterogeneidade na duração de seguimento, que variou entre 1‐48 meses. Por essa razão, utilizou‐se como evento de interesse o desenvolvimento de CIT em qualquer momento durante o seguimento, e não aos três ou seis meses, uma vez que na prática clínica este é o evento relevante, independentemente do período que decorreu entre a QT e a CIT. No entanto, esta abordagem poderá ter levado à subestimação da incidência de CIT em doentes com duração de seguimento mais curto, nos quais a exposição à terapêutica com antraciclinas pode não ter ainda atingido uma dose cumulativa suficiente para levar a degradação da função VE.
Outra limitação prende‐se com o facto de um terço dos doentes apresentar neoplasia da mama HER2 positiva e ter efetuado terapêutica concomitante com trastuzumab, o que limita a generalização destes resultados para doentes sob terapia isolada com antraciclinas. No entanto, uma análise de subgrupo incluindo apenas os doentes submetidos a monoterapia com antraciclinas mostrou resultados semelhantes ao grupo total. Finalmente, não temos informação relativa à terapêutica farmacológica empregue para a prevenção ou tratamento da cardiotoxicidade, pelo que a interpretação dos resultados deverá ter este aspeto em conta.
ConclusõesA contractilidade miocárdica, conforme avaliada por GLS, agravou‐se na maioria dos doentes submetidos a quimioterapia por neoplasia da mama. Esta deterioração parece ter um padrão de envolvimento preferencial do septo interventricular e parede anterior. O agravamento da GLS em doentes com fração de ejeção preservada associou‐se de forma independente à incidência de CIT, podendo pois considerar‐se como um detetor mais precoce da cardiotoxicidade do que o cálculo apenas da fração de ejeção para a monitorização, como é classicamente preconizado.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.