Relata-se o caso de um homem, 35 anos, internado por insuficiência cardíaca, que, desde a infância, apresenta quadro de défice cognitivo moderado, dismorfias faciais, epilepsia, crises de pânico e cardiopatia (estenose aórtica subvalvular) associada a fibrilhação auricular crónica.
Face às dismorfias e espectro clínico, realizou cariotipo, que revelou uma deleção intersticial de novo do cromossoma 8 (região p23.1-p23.2). Esta anomalia cromossómica é rara (cerca de 50 descrições na literatura) e as suas manifestações mais comuns incluem malformações cardíacas, atraso cognitivo e distúrbio comportamental. No presente artigo, descreve-se o primeiro caso associado a estenose aórtica subvalvular e revê-se a literatura disponível acerca desta anomalia cromossómica.
We report the case of a 35-year-old man admitted due to heart failure, who had had moderate cognitive deficit, craniofacial dysmorphism, epilepsy, panic attacks and congenital heart disease (subvalvular aortic stenosis) associated with chronic atrial fibrillation since childhood.
In view of his facial dysmorphism and clinical presentation, karyotype analysis was performed and revealed a de novo interstitial deletion in chromosome 8 in the region p23.1-p23.2. This is a rare chromosomal anomaly (about 50 descriptions in the literature), whose most common manifestations include heart defects, cognitive retardation and behavioral disturbances. In this paper we present the first case with associated subvalvular aortic stenosis and review the literature on this chromosomal abnormality.
As cardiopatias congénitas associam-se em cerca de 17% dos casos a anomalias cromossómicas inframicroscópicas1. Atualmente, com o aperfeiçoamento da terapêutica médica e cirúrgica, a maioria dos doentes (cerca de 85%) com cardiopatia congénita atinge a idade adulta2.
A deleção da extremidade distal do braço curto do cromossoma oito (8p23) é uma anomalia cromossómica rara, cujas manifestações mais comuns incluem malformações cardíacas (mais frequentemente defeito septal aurículo-ventricular), atraso cognitivo e distúrbio comportamental3. Não se encontra, até à data, nenhuma descrição de associação a estenose aórtica subvalvular (EASV).
A EASV pode dever-se a uma membrana fibrosa localizada no trato de saída do ventrículo esquerdo, a uma constrição muscular (espessamento do septo interventricular subvalvular) ou a uma associação das duas anomalias4. A sua associação a outras malformações cardiovasculares é muito variável de acordo com a fonte literária, com valores entre 13 e 71%, sendo mais frequente a associação a defeitos do septo ventricular ou a aorta bicúspide5.
Caso clínicoApresentamos o caso de um homem de 35 anos de idade, caucasiano, que apresenta, desde a infância, quadro de défice cognitivo moderado (iletrado, trabalhando como ajudante em café), dismorfias faciais, epilepsia, crises de pânico, estenose aórtica subvalvular e fibrilhação auricular crónica. Foi submetido a duas cirurgias cardíacas, aos 12 e aos 24 anos, com colocação de prótese mecânica valvular aórtica, resseção do anel fibromuscular subaórtico e correção de fenda mitral. Estava medicado em ambulatório com digoxina, furosemida, acenocumarol, carbamazepina, valproato de sódio, risperidona, alprazolam e loflazepato de etilo. Negava outros antecedentes médicos ou cirúrgicos, tal como hábitos etílicos ou tabágicos.
Como antecedente familiar, destaca-se mãe com dismorfia facial ligeira (paresia facial associada a traumatismo do parto?) e atraso cognitivo ligeiro. Não se verifica história de consanguinidade, casos com fenótipo semelhante nem de cardiopatia ou morte precoce/súbita.
Cerca de uma semana antes do internamento, iniciou um quadro de dispneia de esforço de agravamento progressivo, ortopneia e dispneia paroxística noturna associadas a toracalgia, tosse com expetoração mucosa e crises de pânico de intensidade crescente.
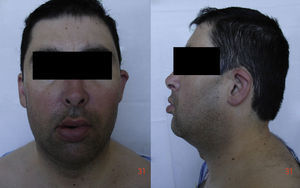
À chegada ao hospital, encontrava-se agitado e polipneico (frequência respiratória de 32cpm), com pressão arterial de 111/75mmHg, pulso de 103bpm (arrítmico) e temperatura timpânica de 36,7°C. A auscultação cardiopulmonar revelou fervores crepitantes no terço inferior de ambos os hemitoraxes, sibilos dispersos e a presença de segundo som de tonalidade metálica relacionável com a prótese mecânica audível em todo o precórdio. Não havia ingurgitamento jugular nem edema periférico. A observação da face (Figura 1) evidenciou dolicocefalia, micrognatismo, base nasal alargada, baixa implantação dos pavilhões auriculares e pescoço largo e curto.
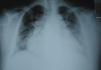
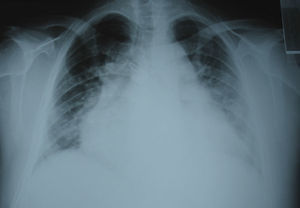
A avaliação complementar inicial evidenciou insuficiência respiratória parcial (Tabela 1). O eletrocardiograma (Figura 2) apresentava fibrilhação auricular com resposta ventricular controlada (90 bpm) e alterações inespecíficas da repolarização ventricular e a telerradiografia PA do tórax (Figura 3) evidenciava cardiomegalia e infiltrado intersticial no terço inferior de ambos os campos pulmonares, sugestivo de edema.
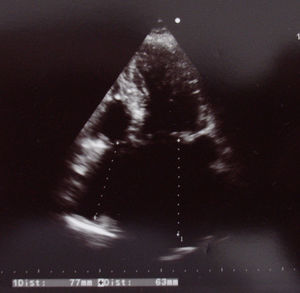
O ecocardiograma (Figura 4) apresentava ventrículo esquerdo ligeiramente dilatado (com boa função sistólica), hipertrofia ventricular esquerda, aurícula esquerda dilatada, prótese mecânica aórtica sem sinais de disfunção e pressão sistólica na artéria pulmonar 35mmHg (sobreponível a exames prévios).
O cariotipo revelou deleção intersticial de um dos cromossomas 8 na região p23.1-p23.2. A análise citogenética por técnica de FISH aos pais demonstrou um cariotipo normal.
DiscussãoA deleção 8p23 (porção mais distal do braço curto do cromossoma 8) foi descrita pela primeira vez em 1988 por Fagan num estudo que permitiu localizar um regulador da atividade do fator vii na banda 8p23.16. Desde então, foram publicados na literatura cerca de 50 portadores desta anomalia cromossómica isolada, com igual frequência entre sexos e grupos étnicos. A ausência de um fenotipo específico, associada à possibilidade de deleções de ínfimas dimensões provavelmente subestima a verdadeira prevalência desta anomalia cromossómica7,8.
A maioria destas deleções são terminais (deleção até à extremidade do cromossoma), contudo em alguns casos, como o do doente em questão, verificam-se deleções intersticiais (não incluindo o término cromossómico) entre as bandas 23.1 e 23.23. Por vezes, nestas últimas, a quantidade de material genético perdido é de reduzidas dimensões, sendo necessário recorrer a técnicas mais sensíveis, como, por exemplo, fluorescence in situ hybridization (FISH) para que seja possível efetuar o diagnóstico7,9. Na maioria dos casos, trata-se de uma anomalia cromossómica de novo7.
O espectro clínico desta síndrome é muito amplo. Encontram-se descritos alguns casos ligeiros, nos quais se destacam pais saudáveis cuja mutação foi identificada apenas após ter sido diagnosticada nos filhos7,8. Na extremidade oposta do espectro, encontram-se relatos de atraso mental e cardiopatia grave com morte no período neonatal.
Entre as manifestações clínicas desta síndrome, salientam-se o atraso do desenvolvimento psicomotor, alterações do comportamento, epilepsia, dismorfias faciais, malformações cardíacas e hérnia diafragmática congénita. Cerca de 50% dos recém-nascidos apresentam baixo peso, atraso do desenvolvimento associado a dificuldades na alimentação e, numa minoria de casos, a refluxo gastroesofágico10,11. Após este período de dificuldade inicial, a maioria das crianças atinge um desenvolvimento estato-ponderal normal, mas mantendo um atraso ligeiro na aquisição de faculdades motoras quer grosseiras7 (como sentar ou andar), quer da motricidade fina, como a escrita3,12.
Caracteristicamente, estes doentes apresentam atraso cognitivo ligeiro a moderado, com importantes variações individuais. A linguagem inicia-se tardiamente, com obstáculo na articulação de diversos sons, para o qual contribuem alterações no palato. As dificuldades de aprendizagem relacionam-se ainda com défice de atenção e com as referidas alterações da motricidade fina3.
Na generalidade, estes doentes exibem um comportamento sociável e afetivo normal. Contudo, podem manifestar alterações súbitas com hiperatividade, impulsividade e agressividade, requerendo, por vezes, medicação7. No entanto, com a idade, estas variações tendem a melhorar9.
As dismorfias faciais são variáveis, mais pronunciadas nas deleções mais extensas, incluindo microcefalia, dolicocefalia, base nasal alargada, pescoço curto, baixa implantação dos pavilhões auriculares e pregas nos epicantos (a maioria das quais encontradas no doente em causa). Numa minoria de casos, verifica-se epilepsia, manifesta principalmente como crises de ausência3,9,11, embora descrevendo-se casos de mal epiléptico7.
As malformações cardíacas constituem o principal fator de prognóstico, estando presentes em cerca de 70% dos doentes. Em 40% dos casos, há necessidade de correção cirúrgica3. Um amplo espectro de anomalias cardíacas tem sido documentado, sendo a mais frequente um defeito septal auriculoventricular3,8,13. Foram ainda identificados casos de estenose pulmonar, comunicação interauricular e interventricular, persistência da veia cava superior esquerda e síndromes de hipoplasia do ventrículo esquerdo ou direito14. Muito raramente, verificou-se a existência de anomalia de Ebstein (2 casos) e tetralogia de Falot (3 casos)3,11,14. Na pesquisa efetuada, não encontrámos nenhum caso de estenose subvalvular aórtica, o que torna o doente em causa ainda mais singular.
Em cerca de 30% dos doentes é diagnosticada hérnia diafragmática congénita, impedindo o normal desenvolvimento do coração e pulmões, justificando, na maioria dos casos, correção cirúrgica13,15.
Na literatura encontram-se apenas cinco descrições de diagnóstico desta síndrome na idade adulta (entre os 22 e os 38 anos), em todos os casos com um fenótipo muito mais benigno do que o deste doente7,8,16.
A variabilidade clínica e a benignidade de alguns dos casos permitem distinguir a deleção 8p23 da bem caracterizada síndrome 8p-7. O amplo espectro clínico desta síndrome tem suscitado a investigação das deleções de genes responsáveis pelas manifestações clínicas descritas. A evidência apoia uma correlação direta entre a dimensão da deleção e a gravidade da doença, postulando-se que os doentes com deleções mais próximas da banda 23.2 ou mais terminais apresentam fenotipo menos grave8,10,11,17.
Alguns genes específicos foram implicados em diversas características clínicas. O mais investigado tem sido o gene GATA-4, localizado na região 8p23.1 e cuja importância é reconhecida no desenvolvimento cardíaco (regula genes críticos para a diferenciação do miocárdio, como troponina C e cadeia pesada da miosina)8,10,11,16,18,19. No entanto, encontram-se relatados casos em que se comprovou a ausência deste gene sem qualquer malformação cardíaca e, inversamente, casos de anomalia cardíaca com integridade do gene8,14. A deleção dos genes adrenal chromaffin granule amine transporter (CGAT) e tankyrase 1 (TKNS) tem sido implicada nos problemas comportamentais e de aprendizagem em virtude da sua elevada expressão no cérebro9, sendo que o último também tem sido associado à presença de hérnias diafragmáticas. Regiões deste cromossoma relacionadas com microcefalia e dismorfias faciais também têm sido investigadas3,10,15.
Resumindo, com este caso clínico, pretende-se alertar para uma anomalia cromossómica rara (mas associada a patologia cardíaca suscetível de correção cirúrgica) e com um amplo espectro clínico, em que o relato de cada novo caso poderá ajudar a completar as diversas alterações sindrómicas possíveis.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Dr.a Ana Madeira, Serviço de Genética do Centro Hospitalar Lisboa Norte, EPE.