A síndrome Takotsubo (STT) é uma forma adquirida e transitória de disfunção sistólica, cuja apresentação clínica e eletrocardiográfica mimetiza um enfarte agudo do miocárdio. A STT é também conhecida como miocardiopatia de stress, síndrome do «coração partido», balonamento apical, insuficiência cardíaca aguda reversível, miocárdio «atordoado» (forma neurogénica) ou miocardiopatia aguda das catecolaminas. Os autores descrevem uma apresentação rara de STT após procedimento anestésico.
Adolescente de 14 anos, sexo feminino, com antecedentes pessoais de enxaqueca hemiplégica e quisto pineal, submetida a ressonância magnética (RM) cranioencefálica de controlo. Durante a indução anestésica com propofol verificou‐se bradicardia, revertida com atropina, seguida de taquidisritmia ventricular, revertida com lidocaína e murro pré‐cordial. Nas primeiras horas de internamento evoluiu para edema pulmonar associado a insuficiência respiratória global por disfunção ventricular esquerda aguda. O ecocardiograma transtorácico mostrou dilatação do ventrículo esquerdo com hipocinesia global e fração de ejeção reduzida (<30%). O eletrocardiograma revelou taquicardia sinusal persistente e alterações inespecíficas do segmento ST. Os biomarcadores cardíacos encontravam‐se elevados (troponina 2,42ng/ml, proBNP 8248pg/ml). Foi medicada com diuréticos, IECA, digitálico e dopamina, com melhoria clínica, bioquímica e ecocardiográfica ao quarto dia. Os ecocardiogramas subsequentes mostraram normalização da função ventricular. A doente teve alta medicada com carvedilol, que suspendeu após normalização da função cardíaca e RM cardíaca não ter revelado alterações.
Estão descritos poucos casos de STT em idade pediátrica. Alguns são desencadeados por patologia aguda do sistema nervoso central, mas nem todos cumprem os critérios de diagnóstico clássicos. Neste caso, o procedimento anestésico poderá ter desencadeado a STT.
Takotsubo syndrome (TTS) is an acquired transient type of systolic dysfunction which mimics myocardial infarction clinically and electrocardiographically. TTS is also known as stress cardiomyopathy, broken heart syndrome, apical ballooning, reversible acute heart failure, neurogenic stunned myocardium or acute catecholamine cardiomyopathy. This case report describes an uncommon presentation of myocardial stunning after an anesthetic procedure.
A 14‐year‐old girl with a history of pineal cyst and hemiplegic migraine was admitted for control brain magnetic resonance imaging. During anesthesia induction with propofol she suffered bradycardia, which was reversed with atropine, followed by tachyarrhythmia, reversed with lidocaine and precordial thump. Within hours she developed pulmonary edema and global respiratory failure due to acute left ventricular dysfunction. A transthoracic echocardiogram showed a dilated left ventricle with global hypokinesia and depressed left ventricular systolic function (ejection fraction <30%). The electrocardiogram showed persistent sinus tachycardia and nonspecific ST‐T wave abnormalities. Cardiac biomarkers were elevated (troponin 2.42 ng/ml, proBNP 8248 pg/ml). She was placed on diuretics, angiotensin‐converting enzyme inhibitors, digoxin and dopamine. The clinical course was satisfactory with clinical, biochemical and echocardiographic improvement within four days. Subsequent echocardiograms showed no ventricular dysfunction. The patient was discharged home on carvedilol, which was discontinued after normalization of cardiac function on cardiac magnetic resonance imaging.
Few cases of TTS have been described in children, some of them triggered by acute central nervous system disorders and others not fulfilling all the classical diagnostic criteria. In this case the anesthetic procedure probably triggered the TTS.
Eletrocardiograma
Inibidor da enzima conversora da angiotensina
pro Peptido Natriurético Cerebral
Ressonância magnética
Síndrome Takotsubo
Ventrículo esquerdo
A síndrome Takotsubo (STT) é uma miocardiopatia incluída nas miocardiopatias não‐classificadas, forma não familiar1. É uma forma adquirida e transitória de disfunção sistólica, cuja apresentação clínica e eletrocardiográfica mimetiza um enfarte agudo do miocárdio2. A STT é também conhecida como miocardiopatia de stress, síndrome do «coração partido», balonamento apical, insuficiência cardíaca aguda reversível, miocárdio «atordoado» (forma neurogénica) ou miocardiopatia aguda das catecolaminas3.
Têm sido propostos vários mecanismos fisiopatológicos, mas a hipótese mais aceite atualmente é o excesso de catecolaminas, responsável pela diminuição da contractilidade e função ventriculares1, os quais regressam ao valor basal num período de dias a semanas4. O quadro clínico depende da extensão do miocárdio afetado e do tipo de complicações associadas, podendo incluir dor torácica, dispneia, palpitações, diaforese, náuseas, vómitos ou complicações neurológicas1,3.
Os autores relatam um caso de STT em idade pediátrica, após procedimento anestésico, que se manifestou sob a forma de insuficiência cardíaca e edema pulmonar agudo.
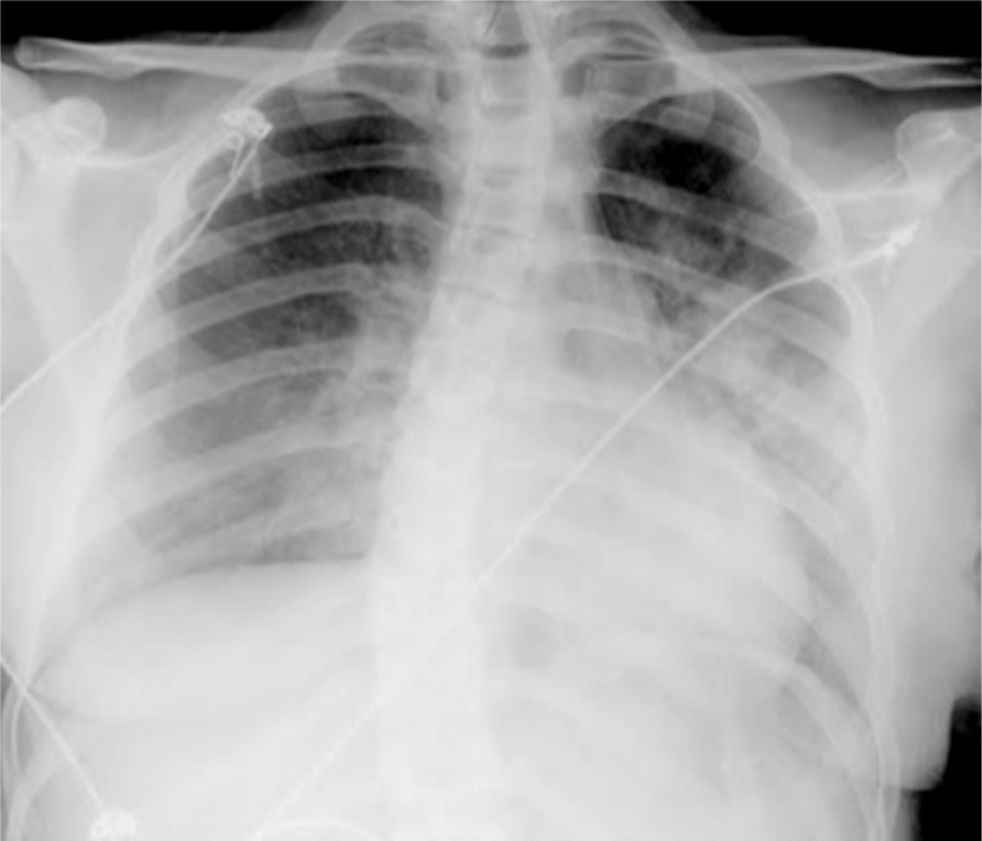
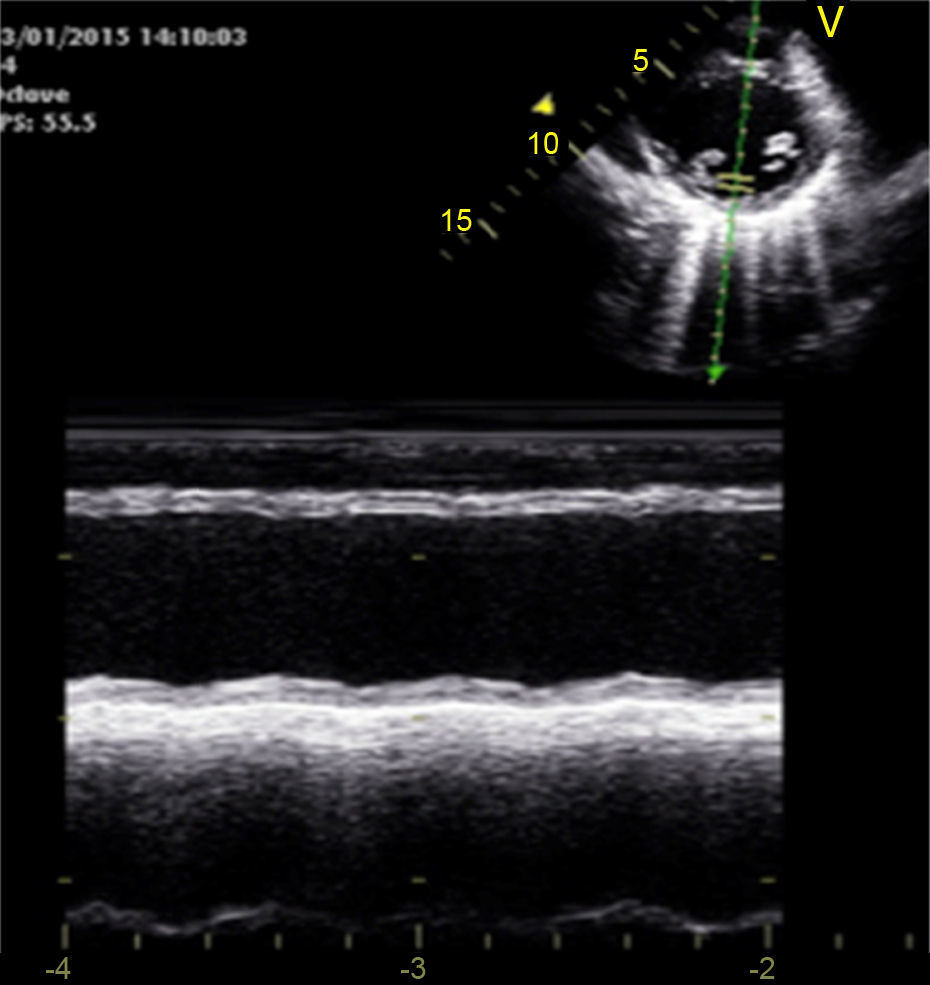
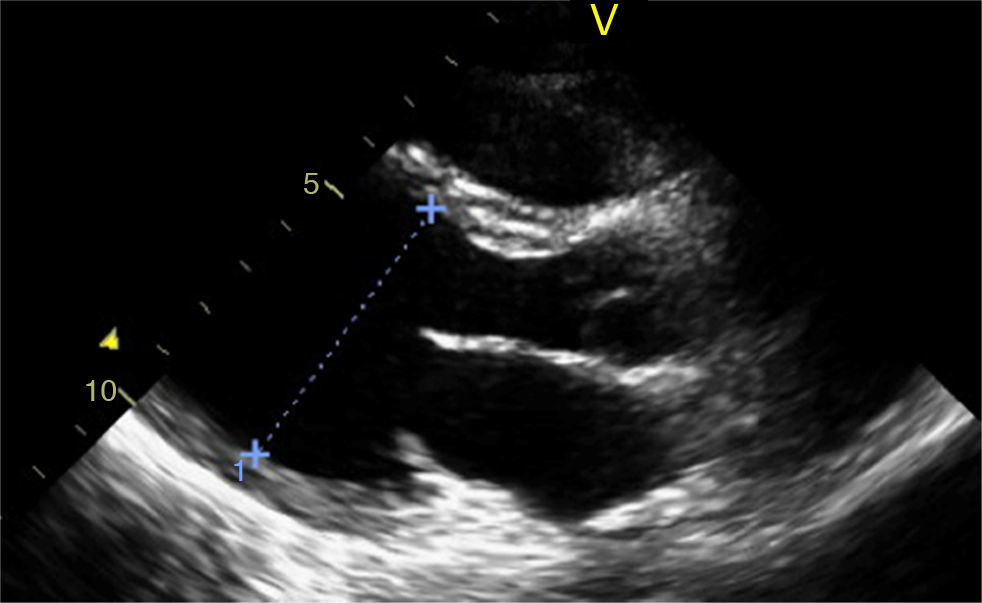
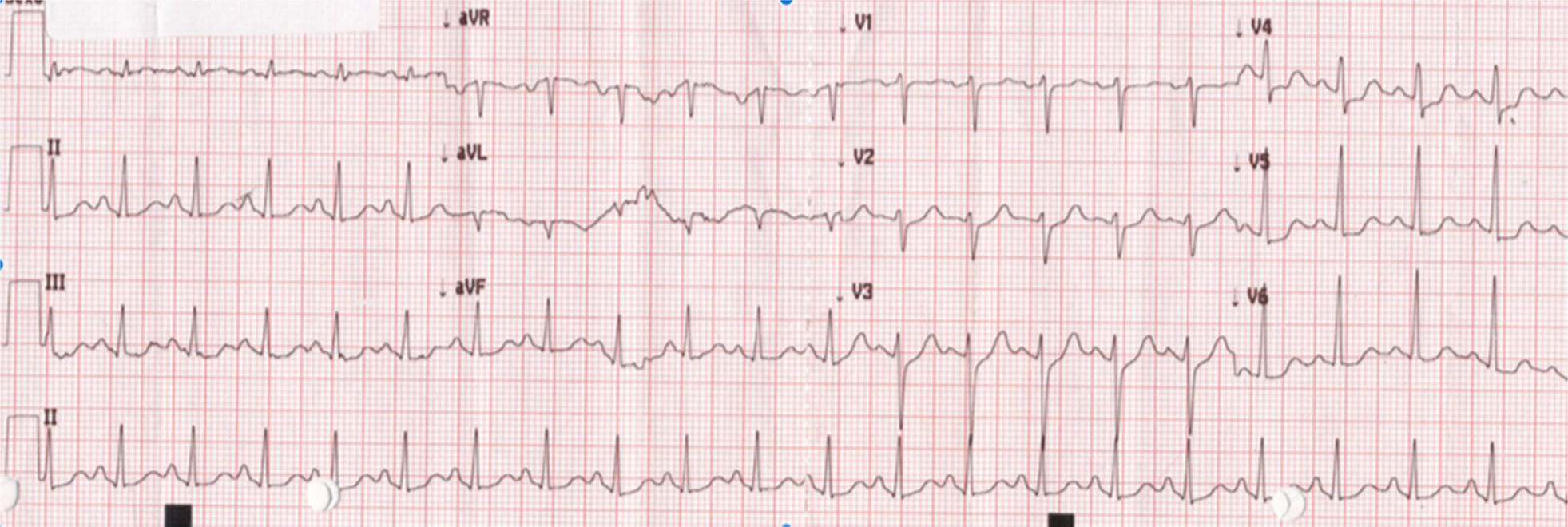
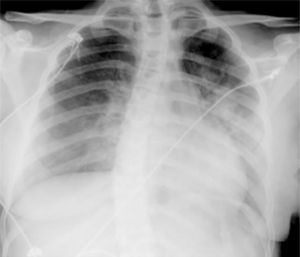
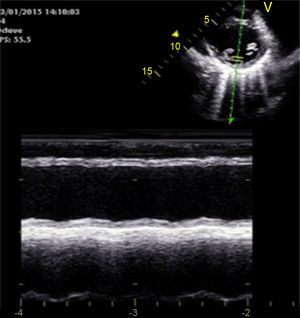
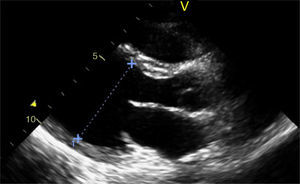
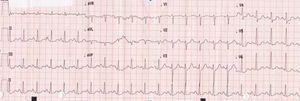
Caso clínicoAdolescente de 14 anos, sexo feminino, com antecedentes pessoais de enxaqueca hemiplégica e quisto pineal, submetida a ressonância magnética (RM) cranioencefálica de controlo. Durante a indução anestésica com propofol verificou‐se bradicardia, revertida com atropina, seguida de taquidisritmia ventricular, revertida com lidocaína e murro pré‐cordial. Nas primeiras horas de internamento evoluiu para edema pulmonar (Figura 1) associado a insuficiência respiratória global (SaFi 156, PCO2 57mmHg) e hipotensão (89/56mmHg, PAS e PAD <p5). O ecocardiograma transtorácico mostrou dilatação do ventrículo esquerdo com hipocinesia global envolvendo todos os segmentos meso‐basais, mas poupando o ápex, condicionando compromisso moderado a grave da função sistólica global do ventrículo esquerdo e fração de ejeção reduzida (<30%) (Figuras 2 e 3). O eletrocardiograma (ECG) revelou taquicardia sinusal persistente e alterações inespecíficas do segmento ST em V4 e V5 (Figura 4). Os biomarcadores cardíacos encontravam‐se elevados (CK total 217UI/L, troponina I 2,42ng/ml, pro Peptido Natriurético Cerebral [proBNP]) 8284pg/ml). Foi medicada com diuréticos e captopril, havendo necessidade de terapêutica com dopamina para otimização da função renal (máximo 2mcg/kg/min) e digoxina nas primeiras 24h. Foram realizados ecocardiogramas diários, verificando‐se melhoria clínica e imagiológica nas primeiras 48h e recuperação completa da função sistólica do ventrículo esquerdo em D4. Os valores dos biomarcadores cardíacos diminuíram ao longo dos primeiros dias (troponina I 0,69ng/ml em D2 e 0,44ng/ml em D3; proBNP 2842pg/ml em D3) com normalização em D6 dos valores de CK I total e troponina I e descida significativa do proBNP (329pg/ml). Suspendeu diuréticos em D9 e teve alta medicada com carvedilol. A RM cardíaca não mostrou alterações, nomeadamente cicatriz de miocardite ou enfarte, tendo suspendido terapêutica com carvedilol. Da investigação realizada salienta‐se função tiroideia normal e serologias virais (CMV, EBV, HSV 1, HSV 2, HSV 6, parvovírus, adenovírus, influenza A e enterovírus) negativas. Manteve acompanhamento regular em consulta de cardiologia pediátrica.
Os autores descrevem o caso de uma adolescente que, em contexto de stress emocional associado a indução anestésica, desenvolveu insuficiência cardíaca com edema pulmonar agudo, elevação dos biomarcadores cardíacos e alterações eletrocardiográficas inespecíficas com posterior recuperação completa da função cardíaca. Esta apresentação é sugestiva de STT, a qual ocorre com maior frequência entre 60‐75 anos de idade e é rara em idade pediátrica. Nesta faixa etária estão descritos apenas 28 casos, alguns dos quais em contexto de patologia aguda ou neoplasia do sistema nervoso central, bem como traumatismo craniano3. No entanto, a STT pode também ocorrer na ausência de patologia neurológica, nomeadamente em contexto de doença sistémica (doença celíaca ou infeção), defeito do septo ventricular, taquicardia ventricular ou mesmo sem fator desencadeante conhecido3.
Outros fatores desencadeantes, tais como situações de stress emocional ou físico, foram descritos em adultos1. De acordo com a literatura revista até à data, existe um caso publicado de STT associado a procedimento anestésico em idade adulta5 e alguns casos no período pós‐operatório neurocirúrgico em idade pediátrica, os quais foram considerados formas neurogénicas6,7.
Em 2004 foram publicados os primeiros critérios de diagnóstico Mayo Clinic8, os quais foram revistos em 2010. Estes últimos são considerados os critérios de diagnóstico clássicos para STT e são os seguintes: 1) hipocinesia transitória, acinesia ou discinesia dos segmentos mesoventriculares esquerdos com ou sem envolvimento apical; anomalias de movimento que se estendem para além de uma única distribuição epicárdica vascular; stress desencadeante frequente, mas nem sempre presente; 2) ausência de doença arterial coronária obstrutiva ou evidência angiográfica de rotura aguda de placa; 3) alterações eletrocardiográficas de novo (elevação do segmento ST e/ou inversão da onda T) ou ligeira elevação da troponina cardíaca; 4) ausência de feocromocitoma e miocardite9,10. No entanto, estes critérios não são consensuais e ao longo do tempo têm sido discutidas outras orientações para diagnóstico da STT. Ainda em 2007 foram propostas orientações diagnósticas pela Japanese Circulation Society, incluindo a revisão da definição da STT, critérios de exclusão e de referência para o diagnóstico11. Estas orientações consideram‐se desatualizadas, uma vez que excluem as formas atípicas de STT em que existe envolvimento de outros segmentos cardíacos para além do ápex, as quais estão descritas atualmente na literatura12. Em 2012 foram publicados os critérios de Johns Hopkins, que incluem definições de diagnóstico obrigatórias e opcionais. Estes últimos excluem a possibilidade de ocorrência de STT em doentes com antecedentes de síndrome coronária aguda13. Ainda em 2012, foram apresentados os critérios de Gothenburg, cujas principais diferenças em relação aos critérios Mayo Clinic incidem sobre a possibilidade de subdiagnosticar a STT ao excluir os doentes com doença arterial coronária ou feocromocitoma. Estes autores salientam ainda a possibilidade de existirem formas ligeiras de STT ou formas variáveis de STT‐like na população geral14. Mais recentemente, em 2014, e à medida que a experiência clínica aumenta, foram propostos novos critérios de diagnóstico de STT que incluem duas novas noções, nomeadamente a existência de formas frustres de STT e a possibilidade de coexistência de comorbilidades desencadeantes de STT ou decorrentes do mesmo, tais como doença coronária aguda12.
Tendo em conta os critérios de diagnóstico clássicos (Mayo Clinic), a realização de cateterismo cardíaco seria necessária para o diagnóstico de STT. No entanto, em idade pediátrica e de acordo com alguns dos casos publicados este critério poderá não estar presente mediante evolução clínica, laboratorial e ecocardiográfica típica e favorável4,15,16.
Relativamente à apresentação ecocardiográfica, pode apresentar‐se sob a forma clássica de STT (com balonamento apical e envolvimento do segmentos apical ou mesoapical) ou forma invertida (com envolvimento dos segmentos meso, basal ou mesobasal)3. O caso acima descrito enquadra‐se nas formas invertida ou global, ambas descritas em idade pediátrica3.
O tratamento da STT é essencialmente de suporte e poderá incluir IECA, beta‐bloqueantes, antagonistas dos canais de cálcio ou diuréticos3, os quais poderão ser usados até recuperação da função cardíaca1. A STT tem bom prognóstico1,3, com normalização dos biomarcadores cardíacos em cinco a sete dias15, do ECG até dez semanas e do ecocardiograma até seis semanas após diagnóstico3. Na STT em idade pediátrica, o tempo decorrido até à recuperação da função cardíaca não está tão bem estabelecido3, mas, em alguns casos, parece ocorrer mais precocemente e até mesmo apenas sete dias após o diagnóstico4,6,15. No caso acima descrito o procedimento anestésico, assim como o eventual stress emocional associado, poderão ter desencadeado a STT. Este deverá ser um diagnóstico a considerar em crianças e adolescentes com sinais de disfunção cardíaca em contexto de indução anestésica e/ou situações de stress emocional ou físico.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.