A ablação septal alcoólica (ASA) é a forma percutânea de tratamento invasivo da cardiomiopatia hipertrófica obstrutiva (CMHO). A propósito da descrição da experiência no nosso centro, procurar-se-á rever as indicações, os aspetos técnicos e práticos e os resultados da ASA, assim como a sua posição atual em comparação com a miectomia cirúrgica.
ObjetivoAvaliar os resultados da ASA numa série de doentes consecutivos tratados nos primeiros quatro anos de atividade.
MétodosEstudo retrospetivo de todos os doentes, consecutivos e não selecionados, com CMHO, tratados por ASA, entre janeiro de 2009 e fevereiro de 2013.
ResultadosDurante o período de quatro anos foram tratados com ASA 40 doentes. Em três doentes (7,5%) repetiu-se o procedimento. A taxa de sucesso foi de 84%. A taxa de complicações minor foi de 7,5%. Foi necessário implantar pacemaker definitivo por bloqueio auriculoventricular em dois doentes (6%, do subgrupo sem pacemaker prévio). A taxa de complicações major foi de 5%. Não houve mortalidade intra-hospitalar nesta população. Durante o seguimento clínico (22±14 meses) a mortalidade cardiovascular foi de 2,5%. A mortalidade total foi de 5%.
Discussão e conclusãoOs resultados apresentados refletem a experiência inicial do tratamento com ASA no nosso centro. O procedimento foi bem-sucedido na maioria dos doentes, sendo a taxa de sucesso semelhante à descrita em outras séries, mas ainda com possibilidade de beneficiar de uma melhor seleção dos doentes. A intervenção também se revelou segura, com uma baixa ocorrência de complicações e sem mortalidade associada. A ASA é uma alternativa percutânea no tratamento invasivo dos doentes com CMHO refratária à terapêutica médica.
We describe our center's initial experience with alcohol septal ablation (ASA) for the treatment of obstructive hypertrophic cardiomyopathy. The procedure, its indications, results and clinical outcomes will be addressed, as will its current position compared to surgical myectomy.
ObjectiveTo assess the results of ASA in all patients treated in the first four years of activity at our center.
MethodsWe retrospectively studied all consecutive and unselected patients treated by ASA between January 2009 and February 2013.
ResultsIn the first four years of experience 40 patients were treated in our center. In three patients (7.5%) the intervention was repeated. Procedural success was 84%. Minor complications occurred in 7.5%. Two patients received a permanent pacemaker for atrioventricular block (6% of those without previous pacemaker). The major complication rate was 5%. There were no in-hospital deaths; during clinical follow-up (22±14 months) cardiovascular mortality was 2.5% and overall mortality was 5%.
Discussion and ConclusionThe results presented reflect the initial experience of our center with ASA. The success rate was high and in line with published results, but with room to improve with better patient selection. ASA was shown to be safe, with a low complication rate and no procedure-related mortality. Our experience confirms ASA as a percutaneous alternative to myectomy for the treatment of symptomatic patients with obstructive hypertrophic cardiomyopathy refractory to medical treatment.
Comemoraram-se recentemente os 50 anos da primeira descrição científica original da cardiomiopatia hipertrófica1. A presença de uma obstrução dinâmica subaórtica foi desde cedo uma das características mais salientes num grupo importante de doentes2.
A heterogeneidade genética e fenotípica desta doença primária do músculo cardíaco condiciona diversas dificuldades na avaliação clínica e atitude terapêutica, tendo dado origem a várias controvérsias no mundo da medicina3. Uma das discussões mais recentes está relacionada com o tratamento invasivo da cardiomiopatia hipertrófica obstrutiva (CMHO). O aparecimento da ablação septal alcoólica (ASA), uma alternativa percutânea à estabelecida miectomia cirúrgica do septo, lançou um embate entre estas duas estratégias terapêuticas que ainda decorre.
A maioria dos doentes com cardiomiopatia hipertrófica tem uma obstrução intraventricular significativa, podendo esta estar presente em repouso ou ser provocada, utilizando-se habitualmente a manobra de Valsalva ou, mais corretamente, o próprio esforço para o fazer4. Esta obstrução é o resultado do systolic anterior motion (SAM) do folheto anterior da válvula mitral, determinado pela força de ejeção do ventrículo esquerdo e pelo estreitamento da sua câmara de saída, havendo também o contributo do alongamento dos folhetos mitrais em alguns doentes5. A obstrução aumenta a pressão intracardíaca, o consumo de oxigénio e o trabalho cardíaco, estando também frequentemente associada a insuficiência mitral, a anomalias do fluxo coronário e a disfunção diastólica. A sua presença está relacionada com a gravidade das queixas e com uma menor sobrevida destes doentes6.
A identificação da forma obstrutiva é importante pois a obstrução constitui per se um alvo terapêutico. A sua redução traduz-se frequentemente numa melhoria ou resolução completa dos sintomas. A terapêutica médica é eficaz na maioria dos doentes e por isso deve ser o tratamento de primeira escolha, utilizando-se fármacos depressores do inotropismo como os beta-bloqueantes, os antagonistas dos canais de cálcio não didropiridínicos ou a disopiramida (não disponível em Portugal). Em 5-10% dos doentes a terapêutica médica não é eficaz, não é tolerada ou está contraindicada7.
As terapêuticas invasivas são a alternativa para os doentes que mantenham queixas, com compromisso da qualidade de vida e em que a estratégia farmacológica não é eficaz. Visam a redução da espessura da porção basal do septo interventricular e a consequente redução da obstrução. A primeira a surgir foi a miectomia cirúrgica, na qual o cirurgião faz uma excisão direta de uma porção do músculo septal, e manteve-se como única alternativa durante décadas. Nos centros com experiência a sua mortalidade é ≤2% em doentes jovens e sem comorbilidades significativas8. Não é considerada uma cirurgia fácil pois o cirurgião tem de lidar com uma grande heterogeneidade da morfologia da câmara de saída do ventrículo esquerdo e fazê-lo através de uma limitada janela transaórtica. No entanto, nos centros com décadas e centenas de casos de experiência é um procedimento muito eficaz, diminuindo de forma significativa o gradiente e os sintomas em 90-95% dos doentes7.
A necessidade de uma outra opção terapêutica para os doentes com contraindicação ou risco cirúrgico elevado deu origem a uma alternativa percutânea. A ASA baseia-se na provocação de uma necrose miocárdica circunscrita ao septo basal, através da injecção intracoronária de álcool. A sua posterior cicatrização leva a uma diminuição de espessura do septo e à consequente diminuição do gradiente subaórtico. A ASA tem sido alvo de controvérsia desde a sua introdução, mas os seus resultados têm contribuído para a sua implementação como uma alternativa para o tratamento invasivo dos doentes com CMHO.
ObjetivoEste trabalho pretende avaliar os resultados da ASA numa série de doentes consecutivos tratados nos primeiros quatro anos de atividade de um único centro terciário de cardiologia.
MétodosEstudo retrospetivo com base em dados colhidos prospetivamente. Foram incluídos todos os doentes, consecutivos e não selecionados, com CMHO e indicação para tratamento invasivo, tratados por ASA desde o início da atividade em janeiro de 2009 até fevereiro de 2013.
Avaliaram-se as variáveis demográficas, as indicações clínicas, a taxa de complicações minor e major e o sucesso do procedimento, assim como a evolução a longo prazo. O sucesso foi considerado quando a melhoria das queixas (diminuição em pelo menos uma classe da New York Heart Association ou CCS) se associou à redução superior a 50% do gradiente em repouso ou provocado3. As complicações major foram definidas como ocorrência de eventos dos quais tenha resultado morte, morbilidade significativa ou risco de vida para o doente durante o procedimento ou no seguimento.
As variáveis categóricas são apresentadas como contagem e percentagem do total. As variáveis contínuas são expressas como média e desvio-padrão. A análise estatística foi realizada com o programa SPSS 20.
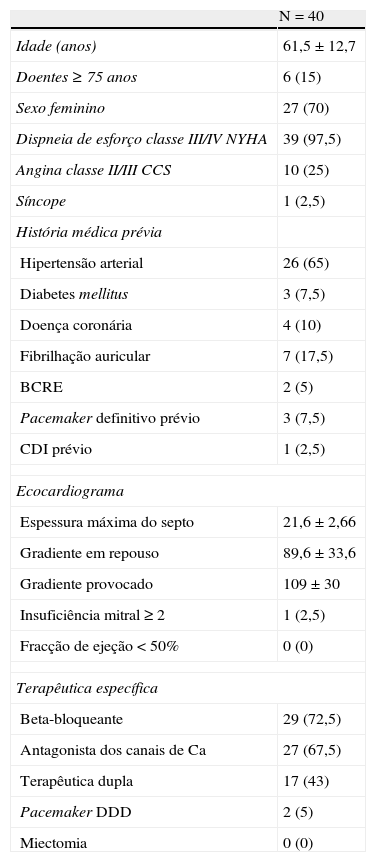
ResultadosDurante o período de quatro anos foram avaliados 43 doentes com indicação para tratamento invasivo, dos quais se excluíram três por não terem um vaso alvo ou por este irrigar zonas remotas. Foram realizados 43 procedimentos em 40 doentes. As principais características de base estão apresentadas na Tabela 1.
Características de base da população
| N=40 | |
| Idade (anos) | 61,5±12,7 |
| Doentes ≥75 anos | 6 (15) |
| Sexo feminino | 27 (70) |
| Dispneia de esforço classe III/IV NYHA | 39 (97,5) |
| Angina classe II/III CCS | 10 (25) |
| Síncope | 1 (2,5) |
| História médica prévia | |
| Hipertensão arterial | 26 (65) |
| Diabetes mellitus | 3 (7,5) |
| Doença coronária | 4 (10) |
| Fibrilhação auricular | 7 (17,5) |
| BCRE | 2 (5) |
| Pacemaker definitivo prévio | 3 (7,5) |
| CDI prévio | 1 (2,5) |
| Ecocardiograma | |
| Espessura máxima do septo | 21,6±2,66 |
| Gradiente em repouso | 89,6±33,6 |
| Gradiente provocado | 109±30 |
| Insuficiência mitral ≥2 | 1 (2,5) |
| Fracção de ejeção <50% | 0 (0) |
| Terapêutica específica | |
| Beta-bloqueante | 29 (72,5) |
| Antagonista dos canais de Ca | 27 (67,5) |
| Terapêutica dupla | 17 (43) |
| Pacemaker DDD | 2 (5) |
| Miectomia | 0 (0) |
Valores apresentados em número (%) ou média ± desvio padrão.
BCRE: bloqueio completo do ramo esquerdo: CCS: Canadian Cardiac Society; CDI: cardioversor desfibrilhador implantável; NYHA: New York Heart Association.
* Percentagem calculada para os doentes sem pacemaker prévio.
A principal indicação foi a existência de dispneia de esforço, estando um doente (2,5%) em classe IV da NYHA. Em um doente (2,5%) a indicação foi exclusivamente por angor de esforço. Seis doentes (15%) eram portadores de pacemaker previamente à intervenção. Deste grupo, uma doente implantou um pacemaker DDD antes da ASA por ter bloqueio de ramo esquerdo de base, o que a colocava num risco elevado de bloqueio auriculoventricular completo (BAV) após a intervenção.
A média do gradiente em repouso da obstrução subaórtica foi de 90±34mmHg e a espessura média do septo de 21,6±4mm. Três doentes (7,5%) tinham gradiente em repouso <50mmHg e a indicação foi colocada pelo gradiente provocado por esforço. Apenas um doente não tinha terapêutica médica por intolerância. Doze doentes (30%) não eram candidatos ideais a miectomia pela idade, obesidade ou pelas comorbilidades associadas, sendo que dois (5%) foram formalmente recusados pela cirurgia.
Os dados relativos à intervenção e evolução hospitalar estão apresentados na Tabela 2. Em todos os procedimentos apenas foi injetado álcool em uma artéria alvo, sendo que em quatro doentes (10%) a artéria alvo foi modificada após a injeção de contraste intramiocárdico. Dois doentes (6%, da população sem pacemaker prévio) necessitaram de pacemaker definitivo por BAV. Em um deles este ocorreu tardiamente ao sétimo dia e após a reintrodução do beta-bloqueante. Em quatro doentes (10%) com BAV após as primeiras 24 horas a utilização do score de risco permitiu uma atitude inicial conservadora, esperando pela resolução do edema perinecrótico e o restabelecimento da condução auriculoventricular, o que aconteceu por vezes apenas ao quinto dia.
Dados da intervenção e da hospitalização
| N=40 | |
| Número de artérias septais | 43 |
| Volume de álcool injectado (ml) | 2,1±0,3 |
| CK máximo (U/ml) | 1.130±438 |
| Score de risco para BAV | |
| Baixo | 27 (75*) |
| Intermédio | 7 (19*) |
| Alto | 2 (6*) |
| Pacemaker definitivo | 2 (6*) |
| Taquicardia ventricular mantida | 0 (0) |
| Fibrilhação ventricular | 1 (2,5) |
| Complicações durante internamento | |
| Major | 2 (2,5) |
| Minor | 3 (7,5) |
| Mortalidade intra-hospitalar | 0 (0) |
Valores apresentados em número (%) ou média ± desvio padrão.
BAV: bloqueio auriculoventricular; CK: retinina quinase.
A taxa de complicações minor foi de 7,5%. Dois doentes tiveram complicações infecciosas resolvidas com antibioticoterapia e uma doente teve fibrilhação auricular rápida com controlo farmacológico da frequência. A taxa de complicações major foi de 5%. Um doente teve tamponamento provocado pela introdução do eletrocateter e resolvido com pericardiocentese e drenagem pericárdica. Um doente teve um enfarte inferior provocado pelo recrutamento de colaterais da septal alvo para a IVP, tendo nas primeiras horas um episódio de fibrilhação ventricular resolvido com choque. Todos os doentes realizaram exame de Holter prévio à alta, não se documentado disritmias ventriculares complexas. Não houve mortalidade intra-hopitalar.
Na Tabela 3 estão presentes os dados do seguimento clínico. A maioria dos doentes teve melhoria dos sintomas associada a redução significativa do gradiente subaórtico. A taxa de sucesso foi de 84%. Em quatro doentes não há informação sobre o gradiente pós-procedimento, três por a intervenção ter sido realizada há menos de três meses e um por dificuldade em repetir ecocardiograma por sequelas neurológicas graves após acidente cerebrovascular. Dois doentes (5%) tiveram acidente cerebrovascular, ambos >30 dias após a intervenção. Quatro doentes (10%) foram reinternados por fibrilhação auricular paroxística e um foi sujeito a terapêutica ablativa com sucesso. Um doente (2,5%) foi reinternado para colocação de CDI por queixas de lipotimia e taquicardia ventricular não mantida (já presentes e documentadas antes da ASA). A mortalidade total foi de 5%. Um doente morreu por provável tromboembolismo pulmonar, 13 meses após a intervenção, e um doente morreu de neoplasia do cólon.
Dados da evolução clínica
| N=39 | |
| Seguimento médio (meses) | 22±14 |
| Melhoria sintomática | |
| Dispneia | 31 (86*) |
| Angor | 9 (90*) |
| Síncope | 1 (100*) |
| Diminuição do gradiente | 33 (89) |
| Sucesso da ASA | 31 (84) |
| Pacemaker definitivo | 0 (0) |
| Colocação de CDI | 1 (2,5) |
| Repetição de ASA | 3 (7,5) |
| Miectomia | 1 (2,5) |
| Sem eventos cardiovasculares | 31 (78) |
| Reinternamento por causa cardíaca | 5 (12,5) |
| Mortalidade | |
| Cardiovascular | 1 (2,5) |
| Súbita | 0 (0) |
| Total | 2 (5) |
Valores apresentados em número (%) ou média ± desvio padrão.
ASA: ablação septal alcoólica; BAV: bloqueio auriculoventricular; CDI: cardioversor desfibrilhador implantável.
Desde o primeiro procedimento realizado por Sigwart em 1994 e descrito, com mais dois doentes, em 19959, a ASA tem sido refinada e alvo de melhoramentos que têm contribuído para a sua maior eficácia e segurança, sendo hoje evidente que os seus resultados competem com os da miectomia cirúrgica. A ASA não tem já um cunho de pioneirismo e de indefinição, sendo pelo contrário uma técnica estabelecida ao longo de quase duas décadas e com mais doentes tratados que a cirurgia10.
A seleção de doentesAs indicações são iguais às da miectomia cirúrgica. É importante salientar que os doentes assintomáticos ou pouco sintomáticos não têm indicação atual para qualquer tratamento invasivo7. Sabe-se que a presença da obstrução é um fator que se relaciona de forma independente com a progressão para insuficiência cardíaca e com a mortalidade6, mas não existe ainda evidência suficiente que permita estabelecer o papel destas terapêuticas na alteração do prognóstico dos doentes, sendo estas advogadas apenas para tratar sintomas significativos que condicionem a qualidade de vida dos doentes.
Os doentes selecionados devem ter dispneia de esforço (classe III ou IV da NYHA), angor de esforço (classe II ou III CCS) ou síncope de esforço, em que foi excluída causa disrítmica. Devem ter uma obstrução dinâmica em repouso ≥50mmHg e/ou provocada ≥70mmHg. Existe uma tendência atual para considerar doentes com valores inferiores: ≥30mmHg em repouso e ≥50mmHg com provocação. Na população descrita, que reflete a experiência inicial e o estabelecimento de uma curva de aprendizagem, optou-se por uma seleção mais conservadora utilizando-se os primeiros critérios. Mais uma vez se destaca que as terapêuticas invasivas só têm lugar quando a terapêutica médica não é eficaz, não é tolerada ou está contraindicada. Em centros de referência a otimização da terapêutica médica em doentes referenciados para tratamento invasivo pode melhorar uma percentagem importante destes e retirar a indicação inicial para ASA ou miectomia11.
Devido ao risco de provocar uma comunicação interventricular iatrogénica a espessura do septo basal deve ser ≥16mm para ASA e para a miectomia. A insuficiência mitral, mesmo que significativa, não é contraindicação para a ASA, desde que seja funcional e relacionada com o SAM, pois melhora com a redução da obstrução. Contudo, a existência de doença mitral primária ou de outra indicação para cirurgia cardíaca deve levar à escolha da miectomia. Em doentes com hipertrofia muito marcada (>30mm) ou na presença de um músculo papilar com implantação anterior, em que este contribui para a obstrução, o sucesso da ASA é menor devendo ser preferida a cirurgia. Para a estratégia percutânea é ainda essencial que a obstrução ocorra ao nível do septo basal e que existam uma ou mais artérias septais, passíveis de cateterização seletiva e que irriguem exclusivamente essa região do septo. A ASA pode ser realizada após miectomia sem sucesso12.
Embora estejam descritos casos de ASA em crianças, muitos dos operadores, incluindo os autores, defendem que o baixo risco cirúrgico em idade pediátrica e a ausência de conhecimento sólido sobre as consequências a longo prazo da necrose miocárdica, num coração jovem e ainda em desenvolvimento, devem levar à opção da estratégia cirúrgica.
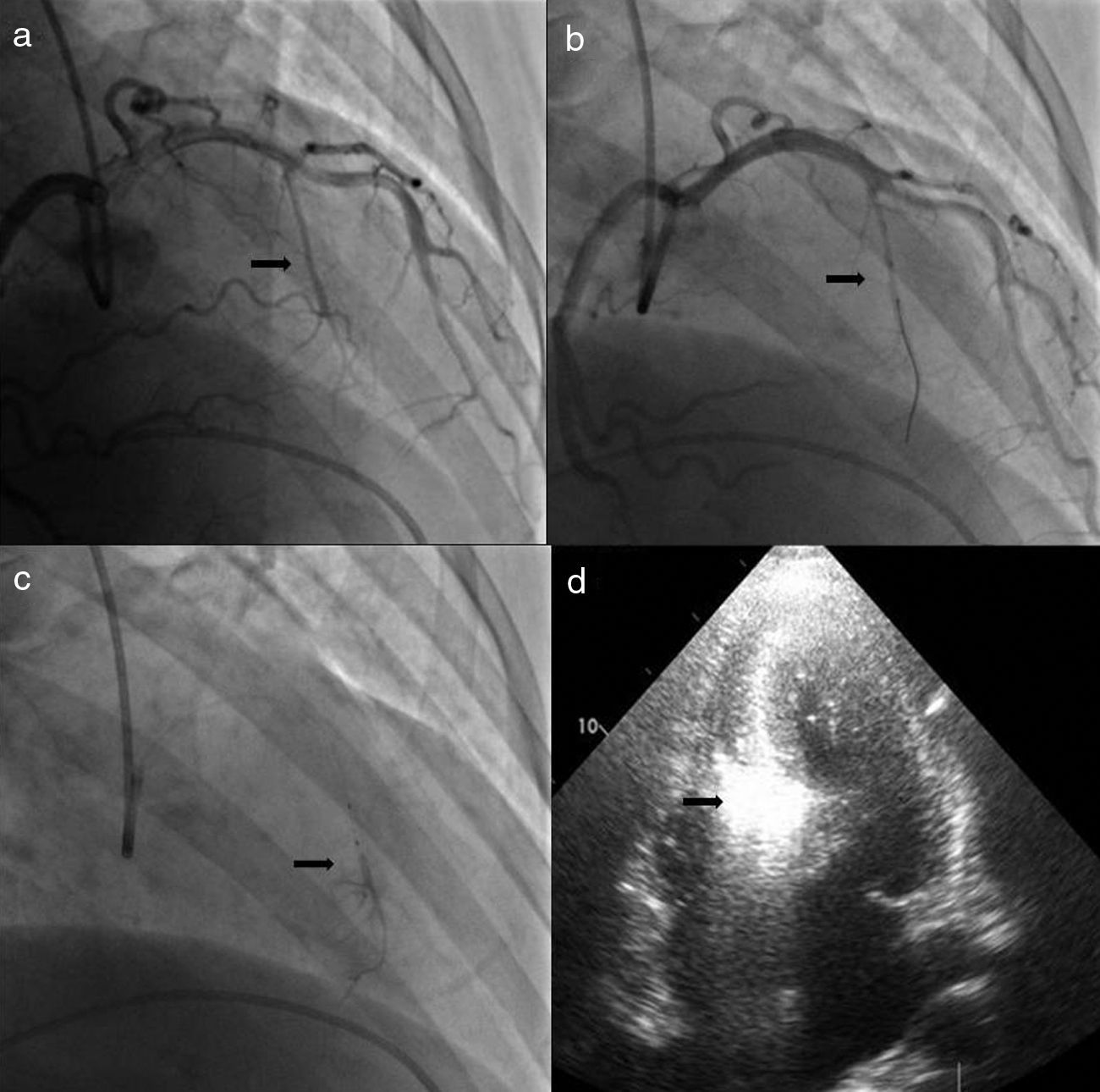
O procedimentoA intervenção inicia-se por uma coronariografia, com identificação da artéria alvo, habitualmente a primeira septal que se ramifica na porção basal do septo, sendo visível nesses vasos a presença de milking sistólico (Figura 1a). Por vezes a septal alvo pode originar-se de uma diagonal, da circunflexa ou mesmo da coronária direita, o que não aconteceu na nossa população. A avaliação da anatomia coronária, da facilidade de acesso ao vaso alvo e do seu calibre, permite a escolha do material a utilizar. Foram usados habitualmente cateteres guia Judkins e EBU de 6F, fios guia BMW® ou Pilot 50® (Abbott Vascular, Santa Clara, Califórnia, EUA) e cateteres de balão over the wire Apex Flex® (Boston Scientific, Natick, MA, EUA). Privilegiou-se a via femoral para favorecer uma maior estabilidade durante a cateterização coronária. Na presença de lesões coronárias significativas e com indicação para revascularização, consideramos que esta deverá ser efetuada primeiro e a ASA protelada para um segundo tempo, após reavaliação das queixas. Num doente da nossa população a origem da septal alvo relacionava-se com uma lesão da descendente anterior, ficando o seu posterior acesso provavelmente comprometido pela colocação do stent, pelo que se optou por realizar primeiro a ASA e de seguida tratar a lesão no mesmo tempo.
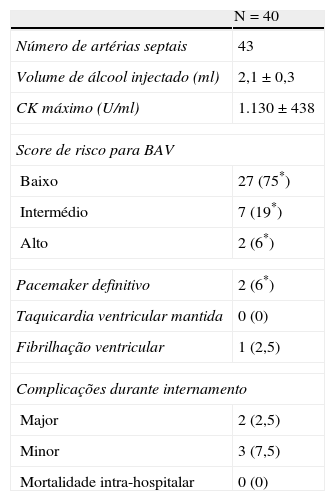
Procedimento. a) Angiografia com incidência oblíqua-direita-cranial da coronária esquerda, mostrando septal alvo. b) Cateterização seletiva da septal alvo com colocação de cateter de balão. c) Angiografia seletiva da septal alvo, com injeção de contraste através do lúmen do cateter de balão. d) Ecocardiografia transtorácica em quatro câmaras. Septo basal hipercogénico após injeção de contrate intramiocárdico, através do lúmen do cateter de balão.
Todos os doentes devem ter um ecocardiograma com Doppler prévio, que permita um diagnóstico claro e uma correta identificação e quantificação da obstrução. Nos doentes em que existem dúvidas na avaliação do componente obstrutivo, dever-se-á proceder à sua avaliação hemodinâmica, utilizando-se o registo simultâneo da pressão da aorta e da pressão intraventricular, quantificando-se o gradiente em repouso, com manobra de Valsalva e após uma sístole prematura ventricular.
Durante o procedimento é efetuada uma primeira avaliação por ecocardiografia transtorácica em que se pretende sobretudo avaliar a ecogenicidade das estruturas cardíacas, para comparação posterior e excluir a existência de derrame pericárdico. Com a confirmação da existência de um vaso alvo é colocado no ventrículo direito um electrocateter para pacing provisório, por via transvenosa femoral ou jugular e após a confirmação da sua posição estável e eficaz é administrada a heparina (70-100U/kg). De seguida, a septal alvo é abordada com um fio guia previamente introduzido no cateter de balão. Através do fio guia o cateter de balão é introduzido no vaso alvo e colocado na zona pretendida (Figura 1b). Esta é escolhida de acordo com o diâmetro do vaso e a existência de bifurcações, a incluir ou não na injeção de álcool, dependendo da sua importância e trajeto. O diâmetro do balão deve ser 0,5mm superior ao calibre do vaso alvo na zona onde se efetuará a insuflação. Um calibre menor pode não ocluir completamente o vaso e permitir o refluxo de álcool para a descendente anterior, por outro lado o sobredimensionamento pode levar ao deslocamento do balão durante a injeção.
Após a insuflação do balão a baixa pressão (4-6ATM) o fio guia é retirado do seu lúmen e através deste é realizada uma injeção com contraste angiográfico, a qual permite visualizar a circulação distal do vaso alvo, excluir a presença de colaterais e confirmar a total oclusão com a ausência de refluxo de contraste para a descendente anterior (Figura 1c). De seguida são injectados 1-2cc de contraste intramiocárdico, inicialmente foi utilizado Levovist® (Bayer AG, Schering AG, Alemanha) e após a sua descontinuação alterou-se para SonoVue® (Bracco, Milão, Itália). Por ecocardiografia transtorácica confirma-se a hiperecogenecidade da região alvo, o septo basal onde ocorre o SAM e a turbulência do fluxo, e exclui-se o envolvimento de regiões remotas, como a parede livre do ventrículo esquerdo, o ventrículo direito e os músculos papilares (Figura 1d).
Tomada a decisão de avançar com a injeção de álcool é efetuada analgesia com morfina (4-6cc e.v, sendo um procedimento bem tolerado na maioria dos doentes) e confirma-se uma vez mais o correto funcionamento do pacemaker provisório. Este último passo é de extrema importância, pois a ocorrência de BAV transitório é muito frequente. Foi utilizado 1cc de álcool por cada centímetro de espessura do septo alvo, com injeção lenta (1cc por minuto) e com visualização constante do balão em posição correta e bem insuflado. No final da administração aguarda-se dez minutos, coloca-se novamente o fio guia no lúmen do cateter de balão, desinsufla-se e remove-se todo o sistema. É realizada uma última angiografia para excluir a presença de dissecção coronária ou compromisso do seu fluxo.
O doente deve permanecer na unidade de cuidados coronários durante as primeiras 24-48 horas. É colocado sob monitorização electrocardiográfica contínua e é avaliada a curva de elevação da creatinina quinase, com análises em intervalos de quatro horas até ao seu pico. A altura em que ocorre este pico é um dos parâmetros incluídos no score de risco de BAV utilizado na nossa população13. Nos doentes de baixo risco o electrocateter é retirado nas 24-48 horas seguintes à intervenção; o doente regressa à enfermaria mantendo monitorização eletrocardiográfica por telemetria e retoma a sua medicação prévia, com beta-bloqueantes e/ou antagonistas dos canais de cálcio, os quais são habitualmente descontinuados antes da intervenção. Na ausência de complicações a alta clínica ocorre ao 6.° ou 7.° dia.
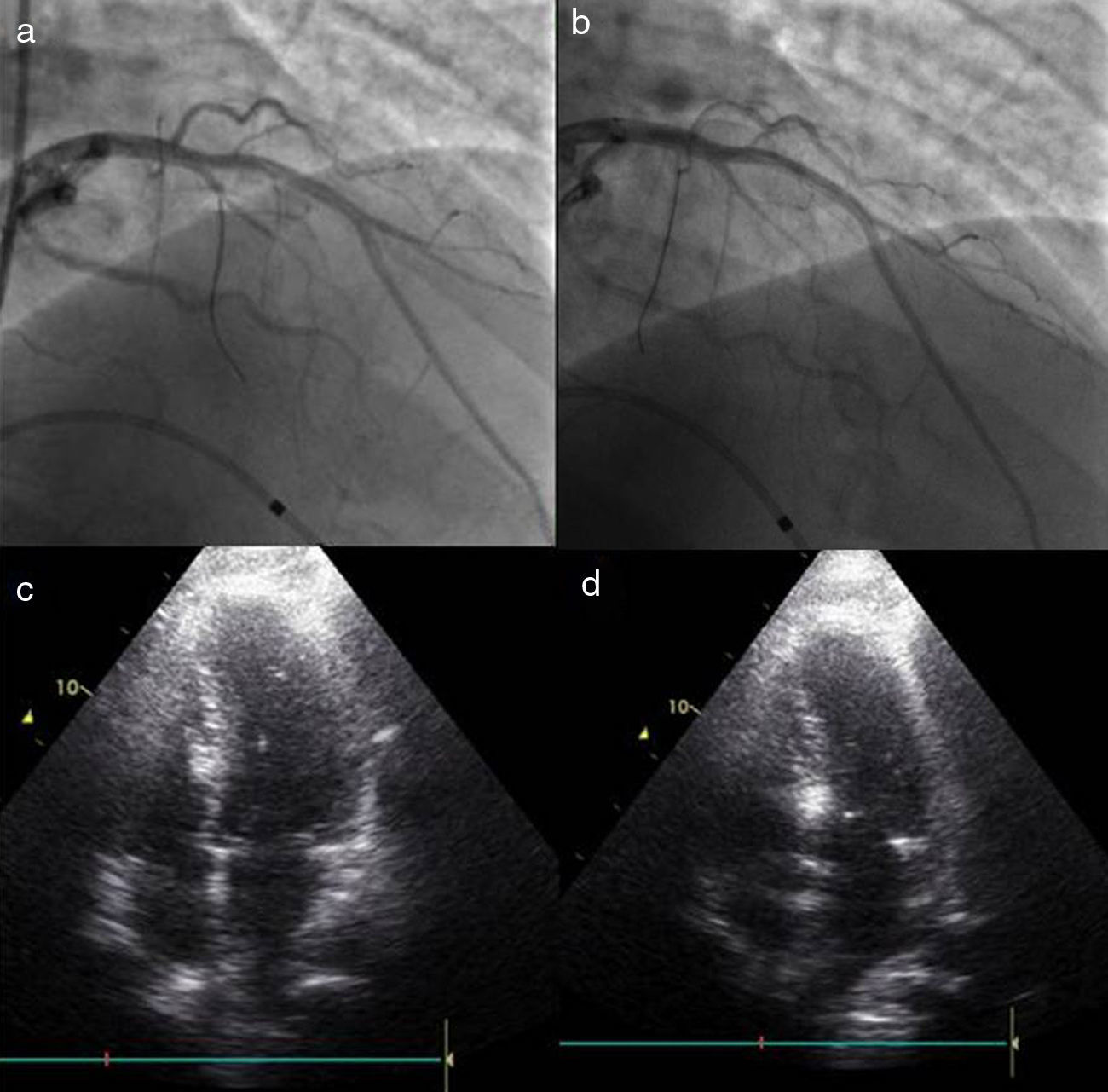
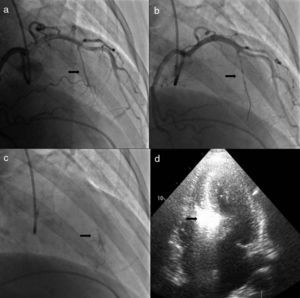
O procedimento descrito tem com certeza pequenas diferenças em relação ao usado por outros centros e operadores, embora os passos fundamentais sejam comuns a todos que privilegiem uma técnica segura. Queremos destacar três alterações que contribuíram para um aumento da sua segurança e para a melhoria dos resultados atuais face aos descritos nas primeiras séries de doentes. A primeira consiste na utilização de menor quantidade de álcool, diminuindo a área de necrose e com isso a possibilidade de afetar o tecido de condução auriculoventricular. Também a ideia de ter um objetivo imediato de redução do gradiente, repetindo as injeções de álcool se necessário, foi abandonada a favor da avaliação dos resultados após a cicatrização e remodeling do septo. A segunda foi introduzida por Faber em 1998, quando utilizou a injeção de contraste intramiocárdio e a ecocardiografia transtorácica para identificar corretamente a artéria septal alvo e excluir a afetação de regiões remotas do miocárdio14. Este é atualmente um passo de grande relevância no procedimento, como exemplifica a nossa experiência em que a artéria alvo foi modificada em 10% dos doentes (Figura 2), sendo que em três doentes (não incluídos nesta população) a intervenção foi abandonada por não existir uma septal alvo em função da informação ecocardiográfica. Por fim, a introdução de scores de risco para o estabelecimento do bloqueio da condução auriculoventricular de alto grau veio permitir distinguir os doentes em que é correto aguardar pela resolução da fase de edema do septo, após a qual se assiste na maioria dos casos à resolução da perturbação da condução, daqueles em que se deve optar logo pela colocação de pacemaker definitivo13.
Alteração da septal alvo após injeção de contraste intracoronário. a) Cateterização seletiva da segunda septal. b) Cateterização selectiva da primeira septal. c) Opacificação da parte direita do septo após injeção de contrate na segunda septal. d) Opacificação da região adequada do septo, porção basal em relação com o folheto anterior da válvula mitral, com injeção de contraste na primeira septal.
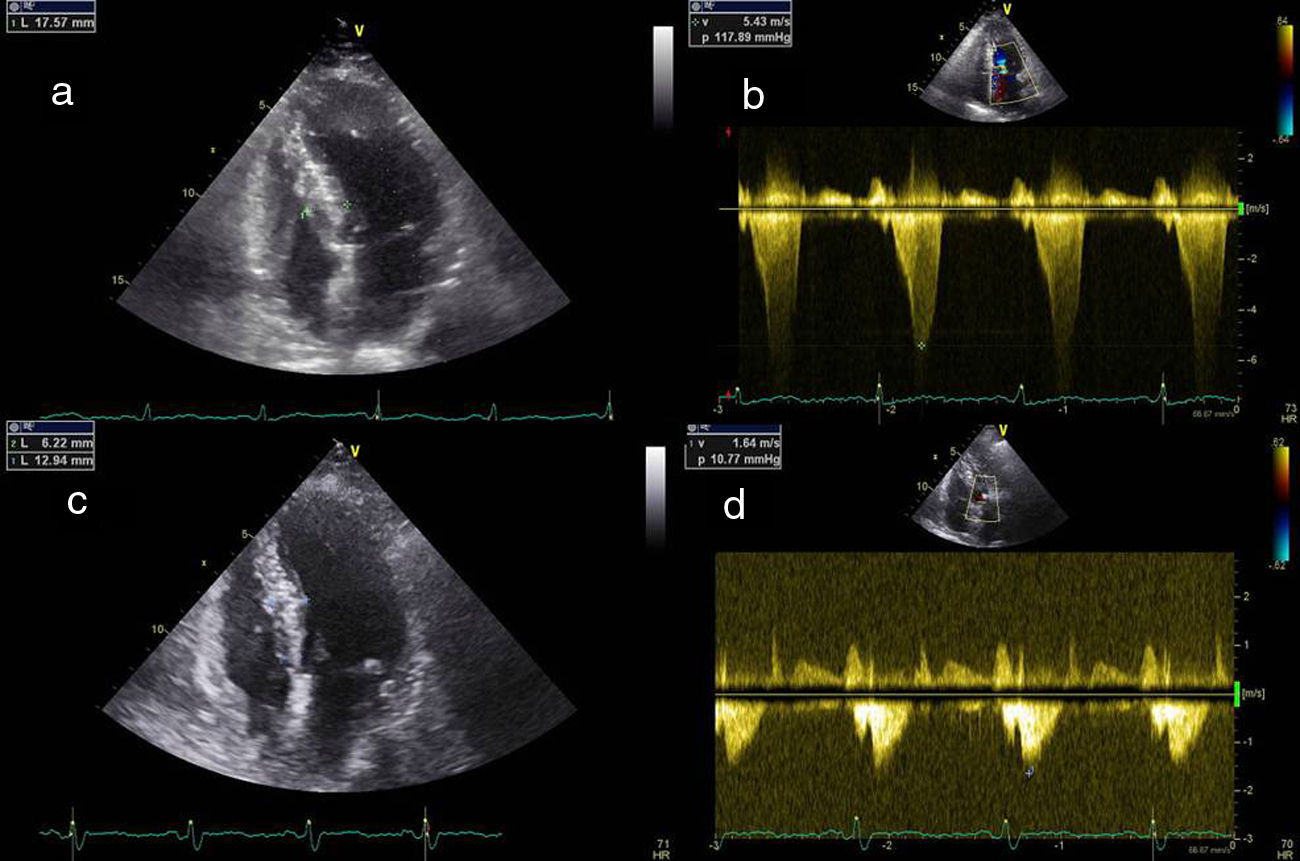
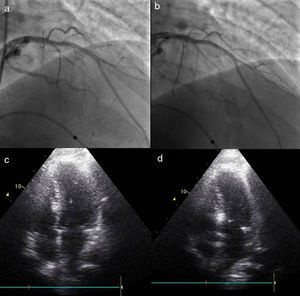
A redução imediata do gradiente não é atualmente considerada um objetivo essencial à eficácia do procedimento. Após ASA a obstrução evolui em três fases: logo após a administração intracoronária do álcool existe diminuição do gradiente por stunning do miocárdio, de seguida ocorre um agravamento da obstrução provocada pela fase de edema da região necrosada e que dura cerca de 5-10 dias, por fim dá-se a fase de cicatrização e remodeling, que se estabelece por volta dos três meses sendo ainda de esperar melhoria do gradiente até 12 meses após a intervenção15 (Figura 3).
Resultados ecocardiográficos após três meses. a) Ecocardiografia transtorácica quatro câmaras prévia à intervenção. b) Doppler contínuo mostrando gradiente subaórtico prévio à intervenção. c) Ecocardiografia transtorácica quatro câmaras, três meses após a intervenção, mostrando diminuição da espessura da porção basal do septo. d) Doppler contínuo três meses após intervenção mostrando diminuição do gradiente subaórtico.
Em 2006, Alam et al. publicaram uma meta-análise de 42 estudos sobre os resultados da ASA em 2954 doentes16. Aos 12 meses houve uma redução mantida do gradiente em repouso e provocado (65,3-15,8 e 125,4-31,5mmHg, respetivamente), acompanhado por uma redução da espessura do septo basal (20,9-13,9mm), melhoria na classe da NYHA (2,9-1,2), e um aumento da capacidade de exercício (325,3-437,5 segundos). A ASA associa-se a uma melhoria mantida das queixas e do gradiente em >85% dos doentes17,18. A repetição do procedimento por manutenção ou recorrência dos sintomas e do gradiente é necessária em cerca de 7% dos doentes, sendo semelhante à miectomia cirúrgica16.
Os benefícios da ASA resultam sobretudo do aumento da área da câmara de saída do ventrículo esquerdo e da redução do gradiente19,20. Além da melhoria dos sintomas também se objetivou a melhoria da reserva do fluxo coronário21, o aumento das dimensões e a diminuição da massa do ventrículo esquerdo22, a diminuição da sua pressão telediastólica14, assim como a redução das dimensões da aurícula esquerda14 e da insuficiência mitral23. Também importante para a melhoria clínica observada constatou-se uma melhoria da função diastólica de ventrículo esquerdo, sobreponível com a da miectomia cirúrgica24,25.
Nos doentes em que o procedimento não tem sucesso a miectomia cirúrgica mantém-se como alternativa, embora com um maior risco de pacing permanente, pois ao bloqueio completo de ramo direito, provocado frequentemente pela injeção de álcool, juntar-se-á o bloqueio do ramo esquerdo causado pela incisão cirúrgica no lado esquerdo do septo.
Segurança e complicaçõesA complicação mais frequente da ASA consiste na ocorrência de bloqueio da condução auriculoventricular de alto grau e irreversível. As melhorias da técnica, anteriormente referidas, permitem compreender a discrepância existente entre os números atuais (<10%) e os apresentados inicialmente por alguns centros17,18. Em alguns doentes a manutenção de BAV, após as primeiras 24 horas, resulta da interferência do processo inflamatório perinecrose no tecido de condução adjacente e não da sua permanente destruição. Na nossa experiência podemos confirmar que em doentes com risco intermédio e que mantenham BAV, é possível aguardar alguns dias pela diminuição do processo inflamatório na zona perinecrose, restabelecendo-se depois a condução intraventricular, não sendo necessária a colocação de pacemaker definitivo.
As outras complicações possíveis são as relacionáveis com o acesso vascular e com a manipulação intravascular dos cateteres, sendo sobreponíveis a uma intervenção coronária percutânea e pouco frequentes na presença de uma técnica cuidada. Alam et al. descreveram a ocorrência de dissecção da descendente anterior em 1,8% dos doentes16. Juntam-se a estas o tamponamento cardíaco provocado pela colocação do eletrocateter de pacemaker provisório e que tem uma incidência descrita de 0,6%16.
O extravasamento de álcool para a descendente anterior ou a sua passagem por colaterais para zonas remotas é um complicação particular da ASA e com consequências graves pois provoca um enfarte não circunscrito e fora da zona alvo. O extravasamento é evitado pelo extremo cuidado em manter a insuflação do balão e a estabilidade de todo o sistema para evitar o refluxo do álcool. O recrutamento de colaterais levanta outras preocupações, pois tal como ocorreu na nossa experiência não são visualizados no início da intervenção, sendo uma complicação não previsível. Contudo, a sua ocorrência é rara, sendo muito poucos os casos publicados. Numa dessas descrições, Chowdhary coloca a hipótese de o recrutamento de colaterais poder ser facilitado por uma maior duração da oclusão do vaso alvo antes da administração do álcool26. De facto, no caso do nosso doente a oclusão do vaso foi prolongada pela necessidade de substituição da sonda do ecógrafo. Desde então a limitação do tempo de oclusão passou a ser mais um dos aspetos técnicos que consideramos com atenção.
A criação de uma cicatriz septal intramiocárdia foi encarada com preocupação pelo seu potencial arritmogénico, numa doença onde existe já um substrato para as complicações disrítmicas. No entanto, após quase 20 anos de experiência e de milhares de procedimentos realizados este receio não se consubstanciou, como será discutido mais à frente (vide Comparação com miectomia). A ênfase deve ser dada na estratificação do risco disrítmico, que tem de ser uma preocupação constante no tratamento da cardiomiopatia hipertrófica.
A mortalidade intrahospitalar da ASA é cerca de 0-4%27, sendo menor nos centros com mais experiência em ASA e em intervenção percutânea, refletindo o percurso da necessária curva de aprendizagem. Mais recentemente, Kwon et al. apresentaram uma mortalidade de 0% durante o procedimento em doentes com elevado risco cirúrgico28. Na revisão de Alam et al. a mortalidade precoce (30 dias) foi 1,5% (0,0-5,0%) e a tardia (depois de 30 dias) foi 0,5% (0,0-9,3%)16.
Comparação com miectomiaTal como em outras patologias em que as terapêuticas percutâneas e as cirúrgicas surgem com tratamentos opcionais, competitivos ou complementares, a escolha da melhor estratégia a adotar tem sido alvo de grande controvérsia. O que parece ser consensual é a baixa probabilidade de vir a ser realizado um grande estudo, aleatorizado e multicêntico, em que ambos os tratamentos fossem comparados e que contribuísse para o esclarecimento definitivo sobre qual a estratégia a ser privilegiada29. A baixa prevalência da CMHO e a ausência de motivação financeira (não há tecnologia dedicada ou propriedade intelectual envolvidas) tornam a implementação desse estudo muito difícil. O que atualmente se pode comparar são as limitações inerentes a cada técnica e os resultados observacionais publicados e já reunidos em meta-análises.
Os defensores da cirurgia referem frequentemente a sua maior experiência a longo prazo, embora este argumento seja cada vez mais esbatido pelo passar dos anos e pelo facto de atualmente existirem mais doentes tratados de forma percutânea do que por miectomia. A cirurgia permite lidar com algumas limitações anatómicas da ASA, tal como a reparação da válvula mitral ou uma maior ressecção de músculo hipertrofiado, conseguindo de forma consistente uma maior e mais rápida redução do gradiente intraventricular, embora tal não pareça influenciar diferenças na evolução clínica. Com a miectomia a ocorrência de BAV completo e mantido é menor, cerca de 5% contra os 10% da ASA, sendo esta provavelmente a principal diferença dos resultados obtidos entre as duas técnicas30.
A ASA tem as qualidades de outros tratamentos percutâneos. É menos invasiva, não necessita de esternotomia, permite uma recuperação mais rápida e possibilita o tratamento de doentes com contraindicações para cirurgia (relativas ou absolutas), como os idosos, os obesos ou os que tenham comorbilidades significativas. Os seus resultados clínicos têm sido sobreponíveis aos da miectomia, tal como verificado em duas meta-análises recentes, sendo a única diferença a necessidade de pacemaker definitivo30,31. Estes resultados refletem ainda uma necessária curva de aprendizagem da ASA, a qual também existiu para a miectomia, mas que está ausente nas publicações mais recentes. Uma das principais limitações da ASA está ligada à necessidade de haver condições anatómicas favoráveis e a uma maior imprevisibilidade dos resultados, embora esta seja diminuída por uma correta seleção dos doentes.
O tema de maior controvérsia tem sido o receio de um aumento do risco de disritmias ventriculares com a ASA. Estes receios foram ampliados pelos resultados de alguns estudos observacionais de pequena dimensão32,33, os quais foram refutados por outros pequenos estudos observacionais, que apontavam para a segurança da técnica34,35. A contradição e a insuficiência da evidência existente geraram confusão. Foi preciso haver estudos de grande dimensão com populações de doentes tratados por ASA, com resultados a longo prazo, e meta-análises a comparar os resultados estre as duas técnicas para clarificar esta questão. Em 2008, Kuhn et al. publicaram os resultados de 644 doentes consecutivos tratados com ASA ao longo de um período de dez anos36. A mortalidade cardíaca anual após alta hospitalar foi de 0,7%, o que não parece fundamentar um maior risco de morte súbita nesta população pois é semelhante à da população não tratada37. A última e maior meta-análise a comparar a ASA e a miectomia teve o objetivo de avaliar a mortalidade e a morte súbita em particular38. Entre os 2207 doentes tratados com ASA e os 1887 sujeitos a miectomia não houve diferenças em relação à mortalidade total e à ocorrência de morte súbita, apesar da população tratada cirurgicamente ser mais jovem.
ConclusãoOs resultados da experiência inicial do nosso centro confirmam a eficácia e a segurança da ablação septal alcoólica no tratamento invasivo dos doentes com cardiomiopatia hipertrófica obstrutiva refratária à terapêutica médica. Esta alternativa percutânea é uma opção válida para uma estratégia invasiva de redução da obstrução subaórtica destes doentes.
Responsabilidades éticasProteção dos seres humanos e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.