A insuficiência cardíaca (IC) é uma das entidades mais prevalentes em todo o mundo e o seu prognóstico, apesar dos avanços terapêuticos, continua reservado. De entre as múltiplas comorbilidades, os distúrbios respiratórios do sono (DRS) são frequentes na IC e agravam o seu prognóstico. Estudos preliminares observacionais sugeriam que o tratamento dos DRS poderia modificar o prognóstico da IC, motivo pelo qual o tema tem ganho importância nos últimos anos. O diagnóstico dos DRS é caro e moroso, pelo que subótimo, com necessidade de dispositivos de rastreio mais fáceis de usar e validados nesta população de doentes. O tratamento em primeira linha passa pela otimização da terapêutica médica da IC. A pressão positiva contínua na via aérea (CPAP) é utilizada em doentes com predomínio de apneia obstrutiva. Já nos doentes com predomínio de apneia central, o CPAP não é suficiente e a servo‐ventilação adaptativa (SVA), apesar de ter mostrado resultados promissores em estudos observacionais, não mostrou benefício nos doentes com IC sintomática e fração de ejeção deprimida no estudo aleatorizado SERVE‐HF; pelo contrário, registou‐se, inesperadamente, um aumento da mortalidade no grupo do SVA em relação ao grupo controlo, razão pela qual está contraindicada nestes doentes, pondo em causa a definição e etiopatogenia dos DRS e estratificação de risco destes doentes. Existem muitas lacunas na evidência, pelo que será necessária mais investigação para um melhor entendimento deste tema: definição, métodos simples de rastreio, bem como da necessidade ou não, e melhor forma de tratar os DRS nos doentes com IC.
Heart failure (HF) is one of the most prevalent conditions worldwide and despite therapeutic advances, its prognosis remains poor. Among the multiple comorbidities in HF, sleep‐disordered breathing (SDB) is frequent and worsens the prognosis. Preliminary observational studies suggested that treatment of SDB could modify the prognosis of HF, and the issue has gained importance in recent years. The diagnosis of SDB is expensive, slow and suboptimal, and there is thus a need for screening devices that are easier to use and validated in this population. The first‐line treatment involves optimization of medical therapy for heart failure. Continuous positive airway pressure (CPAP) is used in patients who mainly suffer from obstructive sleep apnea. In patients with predominantly central sleep apnea, CPAP is not sufficient and adaptive servo‐ventilation (ASV), despite promising results in observational studies, showed no benefit in patients with symptomatic HF and reduced ejection fraction in the SERVE‐HF randomized trial; on the contrary, there was unexpectedly increased mortality in the ASV group compared to controls, and so ASV is contraindicated in these patients, calling into question the definition and pathogenesis of SDB and risk stratification in these patients. There are many gaps in the evidence, and so further research is needed to better understand this issue: definitions, simple screening methods, and whether and how to treat SDB in patients with HF.
A insuficiência cardíaca (IC) é hoje uma epidemia reconhecida em todo o mundo, com elevada morbilidade e mortalidade. A sua prevalência é cerca de 1‐2%, podendo ultrapassar os 10% nos indivíduos com 70 anos ou mais1. Em Portugal, varia entre 1,36% na população adulta com mais de 25 anos, e 16% acima dos 80 anos, com uma prevalência da disfunção sistólica de 1,3% e da função sistólica preservada de 1,7%2. Apesar dos avanços terapêuticos, o seu prognóstico a curto e a longo prazo continua reservado, o que tem justificado a procura incessante de fatores modificadores de risco e de tratamentos para os mesmos que, comprovadamente, modifiquem o prognóstico dos doentes. É neste contexto que surge o interesse, nos últimos anos, nos distúrbios respiratórios do sono (DRS), entidade frequente e associada a pior prognóstico nos doentes com IC. Para além da terapêutica otimizada para a IC, colocou‐se a hipótese de que a ventilação não invasiva, descrita como a principal forma de tratamento dos DRS nos doentes sem IC (seja pela pressão positiva nas vias aéreas, contínua [CPAP] ou binível [BPAP], quando predomina a apneia obstrutiva do sono [AOS], seja servo‐ventilação adaptativa [SVA], nomeadamente quando predomina apneia central do sono [ACS]) pudesse ser uma mais‐valia também nos insuficientes cardíacos.
Estudos preliminares observacionais sugeriam efetivamente que o tratamento dos DRS poderia modificar o prognóstico da IC, traduzindo‐se numa redução do número de reinternamentos e da mortalidade a longo prazo3. Os resultados recentes do Adaptive Servo‐Ventilation for Central Sleep Apnea in Systolic Heart Failure (SERVE‐HF)4 vieram frustrar as expectativas, na medida em que o tratamento dos DRS com recurso a SVA mostrou aumentar a mortalidade nos doentes com IC sintomática e disfunção sistólica ventricular esquerda (DSVE). A contradição dos dados oriundos dos estudos observacionais e do SERVE‐HF vem questionar a etiopatogenia dos DRS na IC, desafiando clínicos e investigadores a aprofundarem o conhecimento nesta área. Nesse sentido, os autores fazem uma revisão sobre o tema.
ConceitosA apneia do sono corresponde a uma síndrome caracterizada por paragens respiratórias noturnas com consequente fragmentação no sono, hipersonolência diurna e dessaturação da hemoglobina. De acordo com a American Academy of Sleep Medicine, a apneia define‐se como redução do fluxo respiratório de pelo menos 90% em relação ao basal, com duração igual ou superior a dez segundos, e a hipopneia como redução do fluxo respiratório de pelo menos 30% em relação ao basal de duração igual ou superior a dez segundos, com dessaturação de oxigénio de pelo menos 3% ou associada a despertar5.
Os doentes com IC podem sofrer de ACS, AOS ou ambas. À medida que a gravidade da IC aumenta, a prevalência de ACS aumenta. Na AOS ocorre colapso da via aérea com aumento do esforço respiratório reflexo. Os fatores predisponentes são a obesidade e estrutura craniofacial desfavorável.
Na ACS não há esforço respiratório reflexo durante as apneias ou hipopneias, e o seu mecanismo prende‐se com o aumento da sensibilidade dos quimiorrecetores no tronco cerebral e corpos carotídeos a pequenas variações da pressão parcial de dióxido de carbono (PaCO2), de que resulta hiperventilação inapropriada6,7. Com a consequente redução da PaCO2, o estímulo respiratório é muito baixo e ocorrem as apneias ou hipopneias. Quando o PaCO2 sobe, o ciclo repete‐se. Para além da resposta respiratória exagerada ao dióxido de carbono, outro mecanismo de hiperventilação é a estimulação dos mecanorrecetores vagais pulmonares (recetores J) pela congestão pulmonar, via aferentes vagais8–11. A ACS com padrão cíclico de hiperventilação‐apneia‐hiperventilação é designada por respiração de Cheyne‐Stokes.
O índice de apneia‐hipopneia (IAH) corresponde ao número de eventos (apneias e hipopneias) por hora de sono. Para ser considerado um padrão de apneia do tipo central, no registo polissonográfico o número total de apneias e/ou hipopneias centrais deverá ser superior a 50% do número total de apneias e hipopneias. A apneia do sono pode ser classificada em ligeira (IAH 6‐14/h), moderada (15‐29/h) ou grave (>30/h). O limiar para o tratamento, apesar de não estar inequivocamente estabelecido, parece ser consensual para doentes sintomáticos com IAH>15/h12. Nos doentes com IC, este consenso é ainda dificultado pelo facto da clínica das DRS ser atípica e dos sintomas da IC poderem mimetizar os dos DRS e vice‐versa.
FisiopatologiaA AOS tem sido considerada como um fator de risco independente para IC13. Os principais mecanismos fisiopatológicos de agravamento da IC são o aumento da pressão intratorácica de que resulta um aumento da pré e pós‐cargas, com eventual compromisso da função ventricular esquerda, a ativação excessiva do sistema nervoso simpático e a hipoxemia14.
A ACS tem sido considerada como uma consequência e não causa de IC15. Neste caso, para além da hipoxemia associada, a ativação simpática é predominante e resulta no aumento das resistências vasculares periféricas, taquicardia e estimulação do sistema renina‐angiotensina‐aldosterona.
Em ambas as formas, a variação da pressão arterial e da frequência cardíaca contribuem para disfunção endotelial e elevação de marcadores de inflamação, nomeadamente da proteína C reativa16,17.
Os doentes com DRS têm um risco aumentado de arritmias ventriculares e outras arritmias, nomeadamente fibrilhação auricular (FA)18–20. De acordo com um estudo observacional, as terapias apropriadas por cardioversor desfibrilhador implantável foram mais frequentes à noite em doentes com AOS e durante o dia em doentes com ACS21. Para além do risco arrítmico, as DRS conduzem também a um aumento do risco de fenómenos atero‐trombóticos22 e de alterações metabólicas, nomeadamente diabetes mellitus tipo 223.
Mais recentemente, e sobretudo após o SERVE‐HF, tem surgido a hipótese da ACS ser um mecanismo compensatório nos doentes com IC, com alguns efeitos benéficos, nomeadamente o repouso dos músculos respiratórios e a atenuação da ativação excessiva do sistema nervoso simpático, evitando assim a acidose hipercápnica, o aumento do volume pulmonar no final da expiração e a pressão positiva intrínseca nas vias aéreas24.
EpidemiologiaA prevalência dos DRS na IC é elevada, afetando mais de 50% dos doentes. Oldenburg et al., num estudo com 700 doentes em classe≥II da New York Heart Association (NYHA) e DSVE, encontraram uma prevalência de 76% (40% ACS e 36% AOS), utilizando como cut‐off um IAH≥5/h25. Schulz et al., em 203 doentes em classe II‐III da NYHA com DSVE, mostraram uma prevalência de 77% (28% ACS e 43% AOS), considerando como cut‐off um IAH≥10/h26. Num estudo de Vazir et al., em 55 homens com DSVE e IC sintomática ligeira, 53% apresentavam DRS definido como IAH≥15/h27.
Em doentes com IC com fração de ejeção preservada (FSP), a prevalência não é menos elevada. Chan et al., utilizando um cut‐off de IAH>10/h, mostraram uma prevalência de DRS de 56%, predominantemente AOS28. Também Bitter et al. encontraram uma prevalência de 69% para DRS, definido como IAH≥5/h, superior para a AOS29.
Um estudo observacional prospetivo alemão, envolvendo 1500 doentes com IC e DSVE, revelou uma prevalência de DRS de 80%, apesar da terapêutica otimizada para a IC30. A presença de HTA foi predominante nos doentes com AOS, enquanto a FA e cardiopatia isquémica foram mais prevalentes no grupo com ACS. Nestes doentes, os sintomas mais identificados foram a nictúria, as apneias testemunhadas e a fadiga, atestando a dificuldade na distinção destes sintomas com aqueles relacionados com a própria IC.
DiagnósticoNa prática clínica diária, os doentes com DRS e IC raramente referem sonolência diurna possivelmente pela hiperativação simpática, e, por isso, muitos deles continuam sem ser diagnosticados31. Questionários como a Epworth Sleepiness Scale32, o Berlin Questionnaire33 e o Maislin Questionnaire34 têm sido usados para fazer rastreio de DRS, embora se discuta a sua utilidade.
A polissonografia continua a ser o gold standard para o diagnóstico de DRS. Apesar da informação completa e detalhada que oferece, necessita de recursos técnicos e humanos especializados, sendo uma técnica morosa e dispendiosa, com longas listas de espera, daí a necessidade de protocolos mais simples e acessíveis. Nesse sentido, têm sido introduzidos um grande número de dispositivos portáteis que incluem poligrafia cardiorrespiratória simplificada com canal único ou múltiplo, oximetria e/ou fluxo aéreo nasal35,36, podendo constituir alternativa à polissonografia como exame de rastreio.
Um desses dispositivos de rastreio é o ApneaLink (AL) (ResMed Corp, San Diego, CA). Num estudo de Erman et al. para validação deste aparelho, no rastreio de DRS em 59 doentes diabéticos, o AL forneceu informação fiável, foi fácil de usar, e altamente sensível e específico a calcular o IAH quando comparado com a polissonografia, especialmente para IAH≥15/h (sensibilidade de 91% e especificidade de 95%)37. Ragette et al. também mostraram excelente correlação entre o AL e a polissonografia, com melhores resultados para IAH≥10/h38. Também na respiração de Cheyne‐Stokes, num estudo em 70 doentes (41 deles com IC), o AL mostrou elevada capacidade diagnóstica na deteção destes eventos centrais, quando comparado com a polissonografia (sensibilidade de 87,1% e especificidade de 94,9%)39.
PrognósticoEm resultado da fisiopatologia, não será surpreendente que os DRS se associem a pior prognóstico nos doentes com IC. Enquanto a AOS está descrita como marcador de risco cardiovascular, mais comum nas formas ligeiras de IC (NYHA I II), a ACS poderá ser marcador de gravidade da IC, mais comum nas formas graves (NYHA III‐IV).
A AOS associou‐se a aumento do risco de mortalidade em doentes com IC e DSVE ao longo de um seguimento médio de três anos (hazard ratio [HR] 2,81, p=0,029)40 e em doentes com IC de etiologia isquémica após um seguimento médio de 32 meses (HR 3,03, p=0,043)41. Outros autores relatam resultados semelhantes em doentes com ACS identificada durante a hospitalização, com redução da sobrevivência naqueles com doença mais grave42.
Num estudo envolvendo 784 doentes com IC por disfunção sistólica, a ACS foi preditor independente de reinternamento aos seis meses43. Os mesmos autores reportaram num outro estudo que a AOS e a ACS são ambos fatores independentes de risco para mortalidade pós‐alta, a longo prazo, de doentes internados com IC aguda3.
Nos doentes com IC e ACS, um dos indicadores mais relevantes em termos de prognóstico poderá ser a carga hipoxémica noturna. Num estudo em 963 doentes com IC e DSVE, o tempo com oximetria periférica<90% (T90) associou‐se a um aumento do risco de morte de todas as causas em 16% por hora de T90 em análise multivariada, enquanto que o IAH não foi preditor de morte quando ajustado para as variáveis de confundimento44. O melhor cut‐off nesta população em termos de mortalidade foi um tempo de hipoxemia de pelo menos 22min. De acordo com os autores, a carga hipoxémica noturna pode ser um importante alvo terapêutico; mais importante porventura do que reduzir o IAH, será reduzir o tempo de hipoxemia.
TratamentoApneia obstrutiva do sonoOs dispositivos de pressão positiva são uma terapêutica bem estabelecida no tratamento da AOS, em doentes sem IC45.
Nos doentes com IC e AOS, o CPAP noturno tem mostrado uma redução da sonolência e melhoria da qualidade de vida, bem como uma melhoria da fração de ejeção ventricular esquerda (FEVE) e redução dos níveis de catecolaminas46,47. Num estudo observacional com AOS e IC, o CPAP associou‐se a uma redução da taxa de morte e internamentos48 (tabela 1).
Evidência na apneia obstrutiva do sono e IC
| Autores | Desenho | Principais conclusões |
|---|---|---|
| Mansfield et al., 200447 | Estudo aleatorizado com 40 doentes (CPAP versus placebo) | Melhoria da função ventricular, qualidade de vida e sistema nervoso simpático com CPAP |
| Kasai et al., 200848 | Estudo observacional com 88 doentes | Redução do risco de morte e internamento por IC com CPAP |
| Mehra et al., 201349 | Revisão sistemática e meta‐análise com 14 estudos observacionais | Redução das dessaturações com O2 noturno |
| Buca et al., 200750 | Estudo observacional com 15 doentes | Redução do IAH com diuréticos |
| Araghi et al., 201351 | Revisão sistemática e meta‐análise com sete estudos aleatorizados | Melhoria do IAH com redução do peso corporal |
CPAP: pressão positiva contínua na via aérea; IAH: índice de apneia‐hipopneia
Nos doentes que não toleram o CPAP, a oxigenoterapia noturna mostrou reduzir as dessaturações, embora com prolongamento das apneias e hipopneias49.
A otimização da terapêutica para a IC melhora o débito cardíaco e reduz o edema periférico. Em particular, os diuréticos melhoraram a AOS em doentes com IC e hipervolemia50. A perda de peso também mostrou uma redução significativa no IAH, de acordo com uma meta‐análise com sete estudos aleatorizados51 (tabela 1).
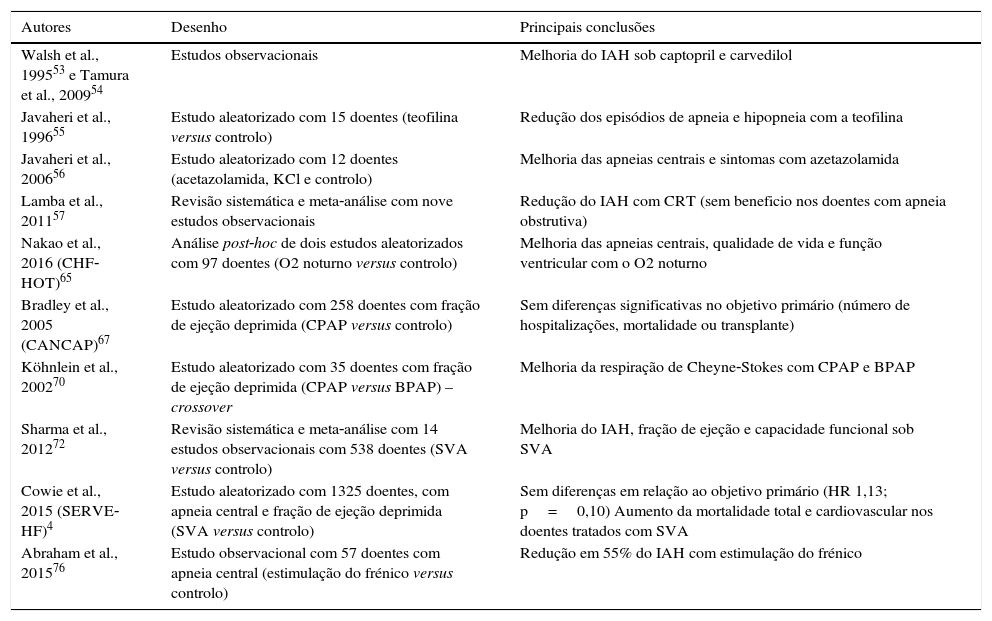
Apneia central do sonoA indicação para tratar e a escolha da modalidade terapêutica para a ACS na IC permanecem incertas. A primeira medida nestes doentes, de acordo com as mais recentes recomendações, será otimizar a terapêutica para a IC52. A terapêutica anti‐remodelagem com inibidores da enzima de conversão da angiotensina e bloqueador adrenérgico mostrou reduzir a ACS na IC congestiva53,54. A teofilina reduziu as apneias centrais em 50% num estudo aleatorizado55, uma vez que estimula a respiração ao antagonizar a adenosina; todavia, pela janela terapêutica estreita e potencial arritmogénico, na prática não é utilizada. A acetalozamida também reduziu as apneias centrais, sonolência diurna e melhorou a qualidade do sono em doentes com IC, uma vez que promove diurese e induz acidose metabólica, estimulando a ventilação56. Contudo, a acetazolamida pode potenciar a hipocaliemia, exercendo um efeito pró‐arrítmico. Segundo uma meta‐análise recente, a ressincronização cardíaca (CRT) em doentes com ACS, DSVE e bloqueio completo de ramo esquerdo mostrou uma redução no IAH em média de 13/h, sendo que nos doentes com AOS não houve benefício na redução do IAH57 (tabela 2). Num estudo observacional, o pacing auricular overdrive obteve uma redução adicional do índice de apneia central quando combinado com CRT58.
Evidência na apneia central do sono e IC
| Autores | Desenho | Principais conclusões |
|---|---|---|
| Walsh et al., 199553 e Tamura et al., 200954 | Estudos observacionais | Melhoria do IAH sob captopril e carvedilol |
| Javaheri et al., 199655 | Estudo aleatorizado com 15 doentes (teofilina versus controlo) | Redução dos episódios de apneia e hipopneia com a teofilina |
| Javaheri et al., 200656 | Estudo aleatorizado com 12 doentes (acetazolamida, KCl e controlo) | Melhoria das apneias centrais e sintomas com azetazolamida |
| Lamba et al., 201157 | Revisão sistemática e meta‐análise com nove estudos observacionais | Redução do IAH com CRT (sem beneficio nos doentes com apneia obstrutiva) |
| Nakao et al., 2016 (CHF‐HOT)65 | Análise post‐hoc de dois estudos aleatorizados com 97 doentes (O2 noturno versus controlo) | Melhoria das apneias centrais, qualidade de vida e função ventricular com o O2 noturno |
| Bradley et al., 2005 (CANCAP)67 | Estudo aleatorizado com 258 doentes com fração de ejeção deprimida (CPAP versus controlo) | Sem diferenças significativas no objetivo primário (número de hospitalizações, mortalidade ou transplante) |
| Köhnlein et al., 200270 | Estudo aleatorizado com 35 doentes com fração de ejeção deprimida (CPAP versus BPAP) – crossover | Melhoria da respiração de Cheyne‐Stokes com CPAP e BPAP |
| Sharma et al., 201272 | Revisão sistemática e meta‐análise com 14 estudos observacionais com 538 doentes (SVA versus controlo) | Melhoria do IAH, fração de ejeção e capacidade funcional sob SVA |
| Cowie et al., 2015 (SERVE‐HF)4 | Estudo aleatorizado com 1325 doentes, com apneia central e fração de ejeção deprimida (SVA versus controlo) | Sem diferenças em relação ao objetivo primário (HR 1,13; p=0,10) Aumento da mortalidade total e cardiovascular nos doentes tratados com SVA |
| Abraham et al., 201576 | Estudo observacional com 57 doentes com apneia central (estimulação do frénico versus controlo) | Redução em 55% do IAH com estimulação do frénico |
BPAP: pressão positiva binível na via aérea; CPAP: pressão positiva contínua na via aérea; CRT: ressincronização cardíaca; IAH: índice de apneia‐hipopneia; SVA: servo‐ventilação adaptativa.
A implantação de dispositivos de assistência ventricular esquerda mostrou melhoria da ACS e da capacidade de exercício em doentes com IC59. Também o transplante cardíaco60 e a substituição valvular mitral, quando indicada61, mostraram melhoria na respiração de Cheyne‐Stokes.
A oxigenoterapia noturna mostrou reduzir a ACS e a atividade simpática, melhorando a qualidade de vida e a capacidade de exercício na IC62–64. Uma análise post‐hoc dos ensaios aleatorizados CHF‐HOT, envolvendo 97 doentes com IC e ACS, mostrou redução do IAH, melhoria da fração de ejeção e classe funcional com oxigenoterapia noturna versus terapêutica médica isoladamente65 (tabela 2).
Os dispositivos de pressão positiva reduzem o edema pulmonar através da redução da pré e pós‐cargas ventriculares, com redução das ACS. Em doentes com IC e ACS, estudos de pequenas dimensões, na sua maioria observacionais, mostraram que o CPAP também melhorou o IAH, a FEVE e reduziu a atividade simpática, com tendência para redução na mortalidade66. Um estudo aleatorizado com CPAP, o Canadian Positive Airway Pressure for Patients with Central Sleep Apnea and Heart Failure Trial (CANCAP), que envolveu 258 doentes com IC por DSVE e ACS, comparou o tratamento com CPAP versus terapêutica médica otimizada. Ao fim de dois anos de seguimento, não se registaram diferenças significativas no objetivo primário do estudo (número de hospitalizações, mortalidade ou transplante)67 (tabela 2). A condicionar este resultado poderá estar o facto de se ter verificado uma fraca supressão das apneias centrais pelo CPAP, uma vez que apenas reduziu o valor médio do IAH para 19/min, acima dos 15/min necessários para entrar no estudo. Uma análise post‐hoc deste estudo mostrou que nos doentes com supressão das apneias centrais para níveis abaixo de 15 eventos/h pelo CPAP, o prognóstico foi melhor68.
Por seu turno, um estudo observacional envolvendo 296 doentes com IC crónica, disfunção sistólica e apneia do sono (central e obstrutiva) mostrou redução da mortalidade a longo prazo nos doentes com apneia do sono grave (IAH>22,5) tratados com CPAP, em comparação com os não tratados69.
O BPAP foi descrito como uma alternativa válida para os doentes que não toleram o CPAP, sendo igualmente eficaz na melhoria da classe funcional NYHA e qualidade do sono nos doentes com IC e ACS70 (tabela 2).
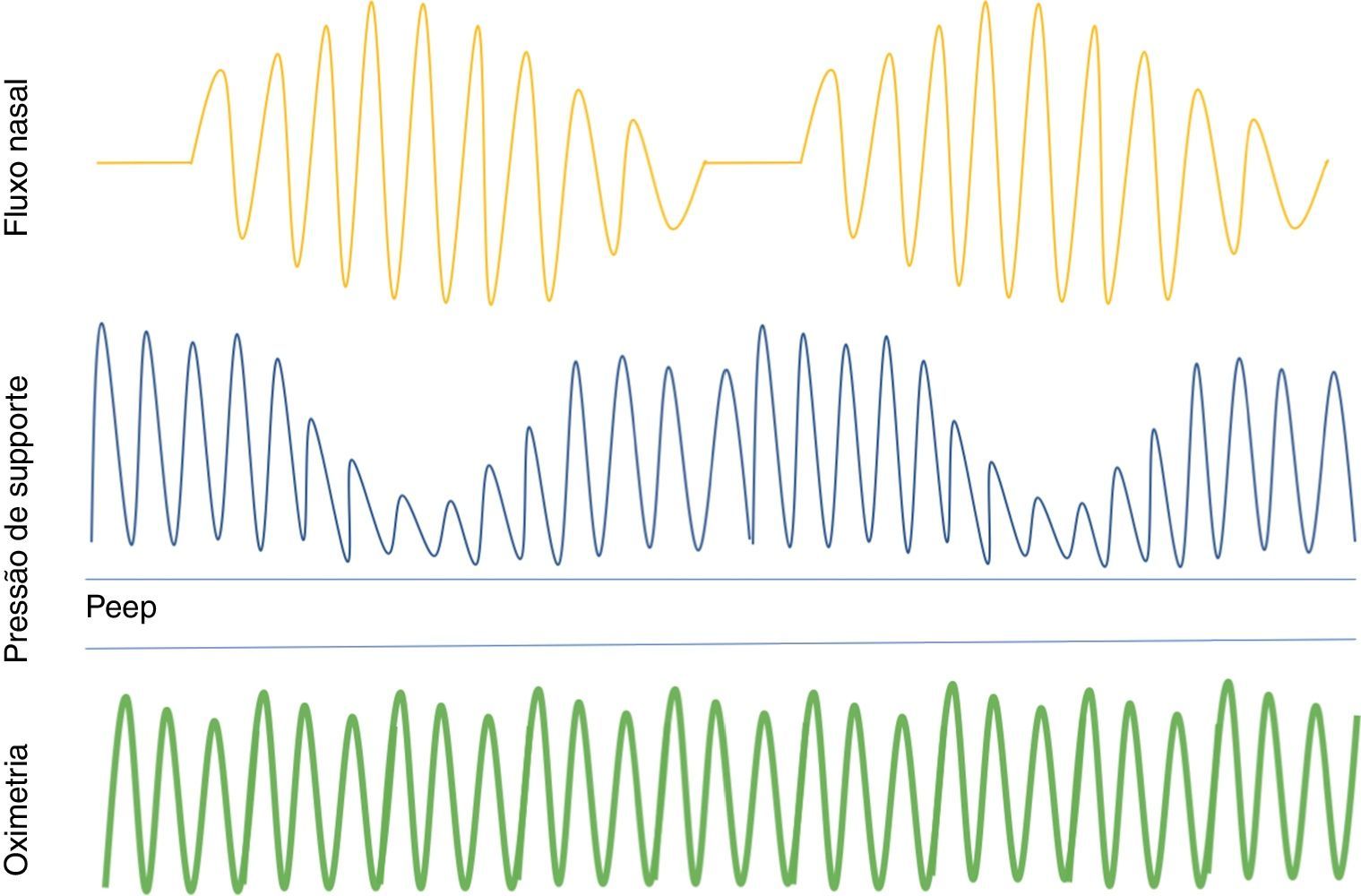
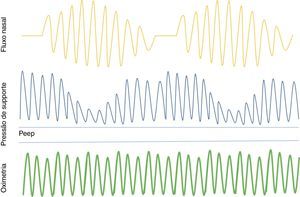
A SVA é uma tecnologia de pressão positiva que controla a pressão na via aérea de acordo com a ventilação do doente e restabelece o padrão normal de respiração, tendo surgido como alternativa promissora ao CPAP no tratamento da ACS na IC (figura 1)71. Numa meta‐análise de estudos em doentes com IC e ACS, a SVA mostrou redução do IAH, melhoria da função cardíaca e da capacidade de exercício72. Uma outra meta‐análise mostrou uma redução significativa na mortalidade de todas as causas com a SVA, em comparação com o CPAP em doentes com IC e DRS73.
Servo‐ventilação adaptativa – mantém a via aérea patente através da pressão positiva no final da expiração (PEEP) e fornece pressão de suporte inspiratória durante a ventilação espontânea. Quando ocorre apneia, aumenta a pressão de suporte ou fornece ventilação mínima de reserva. Assim que volta a ventilação espontânea, o suporte diminui.
Dado estes aparentes benefícios da SVA, 1325 doentes foram incluídos no SERVE‐HF que aleatorizou doentes com IC, DSVE e ACS para terapêutica médica otimizada (grupo controlo) ou SVA (5h por noite, sete dias por semana)4. Após um seguimento médio de 31 meses, apesar do controlo eficaz da ACS pela SVA, não houve diferenças no que respeita ao objetivo primário do estudo, definido como morte de todas as causas, intervenção cardiovascular lifesaving ou internamento não planeado por IC descompensada. A taxa de eventos para o objetivo primário foi de 54,1% no grupo SVA em comparação com 50,8% no grupo controlo (HR 1,13; p=0,10). Para além disso, a SVA quando adicionada ao tratamento padrão não teve nenhum efeito benéfico sobre a qualidade de vida, teste da marcha de 6min ou sintomas. Pelo contrário, a mortalidade de todas as causas e cardiovascular foram superiores no grupo tratado com SVA do que no grupo controlo (34,8 versus 29,3%; HR 1,28; p=0,01 e 29,9 versus 24,0%; HR 1,34; p=0,006). O aumento precoce e sustentado na mortalidade cardiovascular com o SVA foi inesperado, se tivermos em linha de conta os resultados de meta‐análises anteriores (tabela 2). Muito se tem especulado a propósito das causas deste resultado e nas alternativas terapêuticas. Uma possível explicação para estes resultados é que apneia do sono central pode realmente ser um mecanismo compensatório em alguns doentes com IC, na medida em que permite repousar os músculos respiratórios, e modula a atividade excessiva do sistema nervoso simpático. Outra explicação apontada é o facto da pressão positiva na via aérea poder reduzir o volume de ejeção sistólico e o débito cardíaco em alguns doentes com IC, especialmente quando as pressões de encravamento pulmonar são baixas. Recentemente, foi publicada uma subanálise do SERVE‐HF sobre o tipo de morte que conferiu o aumento da mortalidade no grupo tratado com SVA. Efetivamente, neste estudo foi realçado que o grupo dos doentes tratados com SVA teve risco aumentado de morte cardiovascular sem prévia admissão hospitalar por agravamento de IC, sugerindo que o tipo de morte em causa fosse a morte súbita, o que está em consonância com o facto de serem os doentes com fração de ejeção mais baixa (<30%) e sem CDI os mais afetados com um HR de 5,2 (p=0,026)74.
Um dado interessante do SERVE‐HF é que embora a SVA tenha reduzido o IAH e o índice de dessaturação, o T90 foi apenas reduzido de 51min para 19min em média, pelo que muitos doentes mantiveram uma carga hipoxémica considerável.
Da procura de respostas para os resultados inesperados do SERVE‐HF, surge a hipótese de que o alvo terapêutico nos doentes com IC, DSVE e DRS deva ser o T90 e não o IAH, colocando mesmo em dúvida a utilidade do IAH para a definição dos DRS, bem como para a estratificação de risco dos doentes DRS e IC. Todavia e à luz dos resultados do SERVE‐HF, a SVA está contraindicada em doentes com ACS, IC sintomática e FEVE≤45%. De salientar que foram envolvidos neste estudo exclusivamente os doentes com IC, DSVE e predomínio de apneia central, pelo que os resultados não podem ser generalizados aos doentes com IC com FSP ou predomínio de apneia obstrutiva do sono. Está a decorrer um estudo aleatorizado em doentes com IC e DSVE e com ACS ou AOS predominante (ADVENT‐HF; NCT01128816).
A estimulação transvenosa do nervo frénico tem sido sugerida como uma nova abordagem mais fisiológica no tratamento da ACS, capaz de impedir as apneias, eliminando a necessidade de pressão positiva ou de compliance do doente. É implantado um dispositivo muito semelhante a um pacemaker, com um elétrodo na veia pericardiofrénica esquerda ou braquiocefálica direita que estimula o nervo frénico quando nenhum impulso é detetado, num determinado período de tempo. Um estudo observacional, envolvendo 30 doentes com IC e ACS, mostrou que a estimulação unilateral do nervo frénico por via transvenosa reduziu significativamente os episódios de apneias centrais do sono75. Um outro estudo prospetivo, com 57 doentes submetidos a estimulação do nervo frénico, mostrou melhoria no sono, na oxigenação e na qualidade de vida76. Está a decorrer um estudo aleatorizado, multicêntrico, o Remede System Pivotal Trial (NCT01816776), para avaliar a eficácia e segurança do sistema Remede (Respicardia, Inc), que apesar de ser uma técnica invasiva, ganhou interesse redobrado após os resultados negativos do SERVE‐HF.
Perspetivas futurasApós o SERVE‐HF persistem muitas dúvidas quanto à fisiopatologia das DRS nos doentes com IC, bem como à forma de definir e investigar a gravidade da síndrome, nomeadamente se através do IAH ou do T90, e consequentemente quanto aos alvos terapêuticos. Deverá ser testada a repercussão da redução da hipoxemia noturna em vez da redução no IAH na morbimortalidade da síndrome, bem como outras modalidades terapêuticas, nomeadamente a suplementação com oxigénio e estimulação do nervo frénico. De entre outros desafios, persiste ainda a necessidade de uma definição consensual dos DRS na IC, de métodos de rastreio simples e demonstração inequívoca do melhor alvo terapêutico e da modalidade terapêutica mais adequada a cada fenótipo da doença (tabela 3). Sendo certo que os doentes com IC e DRS têm prognóstico agravado, resta demonstrar que o tratamento dos DRS se traduz em benefícios na qualidade de vida e sobrevida dos doentes com IC, e confirmar que os DRS são fator de risco e não um mero indicador de gravidade da IC.
Perspetivas futuras
| Obter definição consensual de DRS |
| Métodos de diagnóstico mais simples, rápidos e de baixo custo. |
| Estabelecer alvo terapêutico consensual: redução do T90 versus IAH |
| Papel da oxigenoterapia |
| Como tratar outras populações de IC e DRS (IC com FSP e DRS ou IC e apneia obstrutiva) – papel da SVA |
| Benefícios reais da estimulação do nervo frénico na IC com DSVE e DRS |
DSVE: disfunção sistólica ventricular esquerda; DRS: distúrbios respiratórios do sono; IAH: índice de apneia‐hipopneia; IC: insuficiência cardíaca; FSP: fração de ejeção preservada; SVA: servo‐ventilação adaptativa.
Os DRS são inequivocamente comorbilidades frequentes na IC que agravam a morbimortalidade, pelo que os especialistas em IC, nomeadamente cardiologistas e internistas, têm que saber suspeitar, diagnosticar e referenciar aos especialistas do sono, bem como controlar os efeitos do tratamento instituído aos seus doentes com IC.
Os estudos das várias modalidades de tratamento têm tido resultados algo inconsistentes, sendo que à luz do SERVE‐HF, a SVA está contraindicada nos doentes com IC por DSVE e ACS. Contudo, estes dados não poderão ser extrapolados para outras populações com IC e FSP, ou aqueles com AOS. O SERVE‐HF abriu novas hipóteses para investigação e os resultados dos estudos em curso poderão ser decisivos para a abordagem adequada dos DRS na IC.
Conflitos de interesseOs autores declaram não haver conflito de interesses.